摘要:8.A.B.C三种元素在周期表中处于相邻位置.A.B同周期.B.C同主族.三元素原子最外层电子数之和为17.质子数之和为31.求此三元素.
网址:http://m.1010jiajiao.com/timu3_id_362636[举报]
 A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如图的反应关系:
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如图的反应关系:(1)若A是淡黄色固体,C、D是氧化物,且C是造成酸雨的主要物质.处理C物质可得到有价值的化学品,写出其中1种酸和1种盐的名称
硫酸、硫酸铵(或硫酸钙等)
硫酸、硫酸铵(或硫酸钙等)
.(2)若B是气态氢化物.C、D是氧化物且会造成光化学烟雾污染.B与C在一定条件下反应生成的A是大气主要成分,写出该反应的化学方程式
4NH3+6NO═5N2+6H2O(一定条件)
4NH3+6NO═5N2+6H2O(一定条件)
.(3)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体.判断单质A的元素在周期表中的位置是
第三周期ⅢA族
第三周期ⅢA族
.写④反应离子方程式AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-
AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-
.(4)若A是太阳能电池用的光伏材料.C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性.写出②反应的化学方程式
Si+2NaOH+2H2O=Na2SiO3+2H2↑
Si+2NaOH+2H2O=Na2SiO3+2H2↑
.D的化学式是Na2CO3
Na2CO3
.(5)若A是应用最广泛的金属.④反应用到A,②⑤反应均用到同一种非金属单质.C的溶液用于蚀刻印刷铜电路板,写该反应的离子方程式
Cu+2Fe3+=Cu2++2Fe2+
Cu+2Fe3+=Cu2++2Fe2+
.A、B、C、D、E、F均为短周期元素,其原子序数依次增大.已知:A的最外层电子数等于其电子层数;B的最外层电子数是次外层电子数的两倍;D是地壳中含量最高的元素;D和F、A和E分别同主族;E是所有短周期主族元素中原子半径最大的元素.根据以上信息回答下列问题:
(1)B与D形成化合物BD2的结构式为
(2)A、C、D三元素能形成一种强酸甲,写出单质B与甲的浓溶液反应的化学反应方程式
(3)均由A、D、E、F四种元素组成的两种盐,其相对分子质量相差16,写出它们在溶液中相互作用的离子方程式为
(4)C2A4─空气燃料电池是一种碱性燃料电池.电解质溶液是20%~30%的KOH溶液.则燃料电池放电时:正极的电极反应式是
(5)已知:2CD2(g)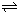 C2D4(g);△H<0.在恒温恒容条件下,将一定量CD2和C2D4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
C2D4(g);△H<0.在恒温恒容条件下,将一定量CD2和C2D4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
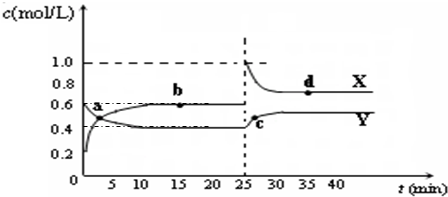
①a、b、c、d四个点中,化学反应处于平衡状态的是
②25min时,增加了
③a、b、c、d四个点所表示的反应体系中,气体颜色由深到浅的顺序是
查看习题详情和答案>>
(1)B与D形成化合物BD2的结构式为
O═C═O
O═C═O
(2)A、C、D三元素能形成一种强酸甲,写出单质B与甲的浓溶液反应的化学反应方程式
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
| ||
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
.
| ||
(3)均由A、D、E、F四种元素组成的两种盐,其相对分子质量相差16,写出它们在溶液中相互作用的离子方程式为
H++HSO3-═SO2↑+H2O
H++HSO3-═SO2↑+H2O
;由B、D、E组成的盐溶于水后溶液显碱性,其原因是(用离子方程式表示)CO32-+H2O HCO3-+OH-
HCO3-+OH-
 HCO3-+OH-
HCO3-+OH-CO32-+H2O HCO3-+OH-
HCO3-+OH-
. HCO3-+OH-
HCO3-+OH-(4)C2A4─空气燃料电池是一种碱性燃料电池.电解质溶液是20%~30%的KOH溶液.则燃料电池放电时:正极的电极反应式是
O2+2H2O+4e-═4OH-
O2+2H2O+4e-═4OH-
.(5)已知:2CD2(g)
 C2D4(g);△H<0.在恒温恒容条件下,将一定量CD2和C2D4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
C2D4(g);△H<0.在恒温恒容条件下,将一定量CD2和C2D4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
①a、b、c、d四个点中,化学反应处于平衡状态的是
bd
bd
点.②25min时,增加了
NO2
NO2
(填物质的化学式)0.8
0.8
mol.③a、b、c、d四个点所表示的反应体系中,气体颜色由深到浅的顺序是
cdba
cdba
(填字母).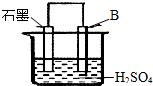 现有A、B、C三种短周期元素,原子序数依次递增.A与C的质子数之和为27,最外层电子数之差为5;0.9g单质B与足量盐酸反应,收集到气体1.12L(标准状况).请回答下列问题:
现有A、B、C三种短周期元素,原子序数依次递增.A与C的质子数之和为27,最外层电子数之差为5;0.9g单质B与足量盐酸反应,收集到气体1.12L(标准状况).请回答下列问题:(1)B元素在元素周期表中的位置是
第三周期 IIIA族
第三周期 IIIA族
(2)A、B、C三种元素最高价氧化物对应的水化物酸性渐强、碱性渐弱的顺序是(写化学式)
NaOH Al(OH)3H2SO4
NaOH Al(OH)3H2SO4
(3)A、B两元素的最高价氧化物对应的水化物之间可以发生反应,其离子方程式
为
Al(OH)3+OH-=AlO2-+2H2O
Al(OH)3+OH-=AlO2-+2H2O
(4)将B单质与石墨按右图装置连接,石墨电极的名称为
正极
正极
;另一电极反应式为:Al-3e-=Al3+
Al-3e-=Al3+
.(5)C的一种氧化物是常见的大气污染物.为防止大气污染,某化工厂用NaOH溶液、石灰和O2处理含C的上述氧化物的尾气,使其转化为石膏(CaSO4?2H2O).假设在转化过程中C元素不损失,每天处理1120m3(标准状况下)含2%(体积分数)上述氧化物的尾气,理论上可以得到多少千克石膏?