题目内容
 现有A、B、C三种短周期元素,原子序数依次递增.A与C的质子数之和为27,最外层电子数之差为5;0.9g单质B与足量盐酸反应,收集到气体1.12L(标准状况).请回答下列问题:
现有A、B、C三种短周期元素,原子序数依次递增.A与C的质子数之和为27,最外层电子数之差为5;0.9g单质B与足量盐酸反应,收集到气体1.12L(标准状况).请回答下列问题:(1)B元素在元素周期表中的位置是
第三周期 IIIA族
第三周期 IIIA族
(2)A、B、C三种元素最高价氧化物对应的水化物酸性渐强、碱性渐弱的顺序是(写化学式)
NaOH Al(OH)3H2SO4
NaOH Al(OH)3H2SO4
(3)A、B两元素的最高价氧化物对应的水化物之间可以发生反应,其离子方程式
为
Al(OH)3+OH-=AlO2-+2H2O
Al(OH)3+OH-=AlO2-+2H2O
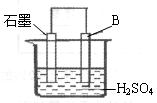
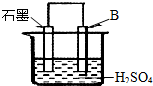
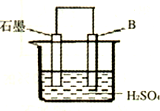
(4)将B单质与石墨按右图装置连接,石墨电极的名称为
正极
正极
;另一电极反应式为:Al-3e-=Al3+
Al-3e-=Al3+
.(5)C的一种氧化物是常见的大气污染物.为防止大气污染,某化工厂用NaOH溶液、石灰和O2处理含C的上述氧化物的尾气,使其转化为石膏(CaSO4?2H2O).假设在转化过程中C元素不损失,每天处理1120m3(标准状况下)含2%(体积分数)上述氧化物的尾气,理论上可以得到多少千克石膏?
分析:(1)设AB在同周期,则B+A=27,B-A=5,可得B=16,A=11即A为钠、B为硫;
假设AB不在同周期,则B+A=27,B-A=5+8,可得B=20(超出短周期舍去).
故A为Na,C为S.
(2)A与C最外层电子数之差为5,故B可能为Al.
(3)氢氧化钠可与氢氧化铝反应,离子方程式为:Al(OH)3+OH-=AlO2-+2H2O
(4)Al是活泼金属,做负极,故石墨为正极.Al失电子:Al-3e-=Al3+
(5)通过元素守恒来看,根据硫元素的物质的量没有发生变化解题.
假设AB不在同周期,则B+A=27,B-A=5+8,可得B=20(超出短周期舍去).
故A为Na,C为S.
(2)A与C最外层电子数之差为5,故B可能为Al.
(3)氢氧化钠可与氢氧化铝反应,离子方程式为:Al(OH)3+OH-=AlO2-+2H2O
(4)Al是活泼金属,做负极,故石墨为正极.Al失电子:Al-3e-=Al3+
(5)通过元素守恒来看,根据硫元素的物质的量没有发生变化解题.
解答:解:(1)假设AB在同周期,则B+A=27,B-A=5,可得B=16,A=11即A为钠、B为硫;
假设AB不在同周期,则B+A=27,B-A=5+8,可得B=20(超出短周期舍去).
A故A为Na,C为S.
A与C最外层电子数之差为5,故B可能为Al,设B的化合价为+3价.
2M+6HCl=2MCl3+3H2
2X 3×22.4
0.9 1.12
X=
=27
原子量为27的元素是:Al,B为Al.
(2)A、B、C三种元素最高价氧化物对应的水化物酸性渐强、碱性渐弱的顺序;NaOH Al(OH)3H2SO4
(3)氢氧化钠可与氢氧化铝反应,离子方程式为:Al(OH)3+OH-=AlO2-+2H2O
(4)Al是活泼金属,做负极,故石墨为正极.Al失电子:Al-3e-=Al3+
(5)由题意可知SO2的体积为1120m3×2%=2.24m3=22400L
再根据V=n×22.4
所以n=22400÷22.4=1000mol
即有1000mol的SO2,即1000mol的S
即有1000mol的CaSO4?2H2O,
又因为CaSO4?2H2O的摩尔质量M=40+32+16×4+18×2=172g/mol
所以m=n×M=1000×172=172000g
故答案为:(1)第三周期 IIIA族
(2)NaOH Al(OH)3 H2SO4
(3)Al(OH)3+OH-=AlO2-+2H2O
(4)正极 Al-3e-=Al3+
(5)172000克
假设AB不在同周期,则B+A=27,B-A=5+8,可得B=20(超出短周期舍去).
A故A为Na,C为S.
A与C最外层电子数之差为5,故B可能为Al,设B的化合价为+3价.
2M+6HCl=2MCl3+3H2
2X 3×22.4
0.9 1.12
X=
| 0.9×3×22.4 |
| 2×1.12 |
原子量为27的元素是:Al,B为Al.
(2)A、B、C三种元素最高价氧化物对应的水化物酸性渐强、碱性渐弱的顺序;NaOH Al(OH)3H2SO4
(3)氢氧化钠可与氢氧化铝反应,离子方程式为:Al(OH)3+OH-=AlO2-+2H2O
(4)Al是活泼金属,做负极,故石墨为正极.Al失电子:Al-3e-=Al3+
(5)由题意可知SO2的体积为1120m3×2%=2.24m3=22400L
再根据V=n×22.4
所以n=22400÷22.4=1000mol
即有1000mol的SO2,即1000mol的S
即有1000mol的CaSO4?2H2O,
又因为CaSO4?2H2O的摩尔质量M=40+32+16×4+18×2=172g/mol
所以m=n×M=1000×172=172000g
故答案为:(1)第三周期 IIIA族
(2)NaOH Al(OH)3 H2SO4
(3)Al(OH)3+OH-=AlO2-+2H2O
(4)正极 Al-3e-=Al3+
(5)172000克
点评:本题考查原子结构与元素周期表的关系,元素金属性强弱与碱性关系,元素守恒思想,难度适中.

练习册系列答案
相关题目
 现有A、B、C三种短周期元素,原子序数依次递增.A与C的质子数之和为27,最外层电子数之差为5;0.9g单质B与足量盐酸反应,收集到气体1.12L(标准状况).请回答下列问题:
现有A、B、C三种短周期元素,原子序数依次递增.A与C的质子数之和为27,最外层电子数之差为5;0.9g单质B与足量盐酸反应,收集到气体1.12L(标准状况).请回答下列问题: