网址:http://m.1010jiajiao.com/timu3_id_362559[举报]
(10分)在一定条件下,物质A~E转化关系如下图所示,其中A为单质,常温下E为无色液体。
(1)若A、C、D均含氯元素,C为氯碱工业的原料,D的溶液具有漂白性。
①A与B反应的化学方程式是 。
②D的溶液可使KI淀粉溶液显蓝色,则D与KI在溶液中反应的离子方程式是 。
③检验C中所含阴离子的实验方法是 。
(2)若A为银白色金属,B为某酸的浓溶液。常温下该反应不能进行,加热后可以发生反应。C可用于做净水剂,D为可形成酸雨的无色气体。C与过量氢氧化钠溶液反应的离子方程式是 。
(3)上述(1)、(2)中的D都能使品红溶液褪色,利用褪色后的溶液探究使其褪色的物质的实验方法是 。
查看习题详情和答案>>
(10分)在一定条件下,物质A~E转化关系如下图所示,其中A为单质,常温下E为无色液体。 
(1)若A、C、D均含氯元素,C为氯碱工业的原料,D的溶液具有漂白性。
①A与B反应的化学方程式是 。
②D的溶液可使KI淀粉溶液显蓝色,则D与K I在溶液中反应的离子方程式是
I在溶液中反应的离子方程式是  。
。
③检验C中所含阴离子的实验方法是 。
(2)若A为银白色金属,B为某酸的浓溶液。常温下该反应不 能进行,加热后可以发生反应。C可用于做净水剂,D为可形成酸雨的无色气体。C与过量氢氧化钠溶液反应的离子方程式是
能进行,加热后可以发生反应。C可用于做净水剂,D为可形成酸雨的无色气体。C与过量氢氧化钠溶液反应的离子方程式是  。
。
(3)上述(1)、(2)中的D都能使品红溶液褪 色,利用褪色后的溶液探究使其褪色的物质的实验方法是 。
色,利用褪色后的溶液探究使其褪色的物质的实验方法是 。
(10分)在一定条件下,物质A~E转化关系如下图所示,其中A为单质,常温下E为无色液体。

(1)若A、C、D均含氯元素,C为氯碱工业的原料,D的溶液具有漂白性。
①A与B反应的化学方程式是 。
②D的溶液可使KI淀粉溶液显蓝色,则D与KI在溶液中反应的离子方程式是 。
③检验C中所含阴离子的实验方法是 。
(2)若A为银白色金属,B为某酸的浓溶液。常温下该反应不能进行,加热后可以发生反应。C可用于做净水剂,D为可形成酸雨的无色气体。C与过量氢氧化钠溶液反应的离子方程式是 。
(3)上述(1)、(2)中的D都能使品红溶液褪色,利用褪色后的溶液探究使其褪色的物质的实验方法是 。
查看习题详情和答案>>
在一定条件下,单质B、C、D、E都能与A单质发生化合反应,转化关系如图所示。已知:①G是黑色晶体,能吸附B单质;②H能与氢氧化钠溶液或盐酸反应;③实验时在G和C的混合物表面加入某强氧化剂粉末,在表面上插入一根除去氧化膜的E片,点燃E引发G与C的反应;④I是绿色植物光合作用的原料,温室中常用它作肥料。根据上述信息,回答下列问题: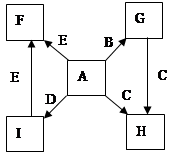

(1)I的电子式为 ,G的俗名是 。
(2)以C和E为电极在NaOH溶液中构成原电池,该原电池的负极反应式为 。
(3)根据E和A反应的能量变化图像写出热化学方程式: 。
(4)两种常见含C元素的盐,一种pH>7,另一种pH<7,写出这两种溶液混合时发生反应的离
子方程式:
(5)写出B在高温下和水蒸气反应的化学方程式并标出电子转移方向和总数 。
2SO2(g)+O2(g)
 2SO3(g) ΔH=-92.3KJ/mol
2SO3(g) ΔH=-92.3KJ/mol 反应过程中,SO2、O2、SO3的物质的量(mol)的变化如下表(0~4min时,容器气体压强为101KPa):

①________________时段,反应处于平衡状态。
②第5min时,从同时提高速率和转化率两个方面分析,改变的外界条件是__________,平衡________移动(填“正向”、“逆向”或“不移动”);n1=_______mol。
II. 在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)常温下,将0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,若混合液体积等于两溶液体积之和,则混合液中下列关系正确的是___________
A.c(HA)<c(A-)
B.c(HA)一定大于0.1mol/L
C.c(Na+)=c(HA)+c(A-)
D.2c(OH-)=2c(H+)+[c(HA)-c(A-)]
(2)常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。

①在同一溶液中,H2CO3、HCO3-、 CO32- (填:“能”或“不能”)_________ 大量共存。
②已知在25℃时,CO32-水解反应的平衡常数(即水解常数用Kh表示)

当溶液中c(HCO3-)︰c(CO32-)=2︰1时,溶液的pH=_________________。
Ⅲ. 已知: H2(g) + 1/2O2(g) = H2O(g) △H =-241.8KJ/mol
CO(g) + 1/2O2(g) = CO2(g) △H=-283.0KJ/mol
CH4(g) + 2O2 (g) = CO2(g) + 2H2O(g) △H =-802.3KJ/mol
甲烷与水蒸气反应生成水煤气的热化学方程式为______________________。