摘要:在一个容积为5L的密闭容器中.充入NH3和O2.它们的摩尔比为1∶2.发生如下反应:4NH3+5O24NO+6H2O(气) (1)上述反应在一定条件下2min后达到平衡.NH3为2mol.NH3的转化率为20%.以NO的浓度变化表示该反应的平均速度为 .O2的平衡浓度为 . (2)在达到平衡后.加入相当于原组成气体1倍的惰性气体.如果容器的体积不变.平衡 移动,如果总压强保持不变.平衡又 移动.
网址:http://m.1010jiajiao.com/timu3_id_362557[举报]
向一个容积为5L的密闭容器中充入NH3和O2,它们的物质的量之比为1:2,发生如下反应:
4NH3(g)+5O2(g)?4NO(g)+6H2O(g)
(1)上述反应平衡常数的表达式为______;
(2)上述反应在一定条件下2min后达到平衡,NH3为2mol,NH3的转化率为20%.用NO的浓度变化表示该反应的平均反应速率为______,O2的平衡浓度为______;
(3)在达到平衡后,加入相当于原组成气体1倍的惰性气体.如果容器的体积不变,平衡______移动(填“正向”、“逆向”或“不”,下同),如果总压强保持不变,平衡______移动.
查看习题详情和答案>>
4NH3(g)+5O2(g)?4NO(g)+6H2O(g)
(1)上述反应平衡常数的表达式为______;
(2)上述反应在一定条件下2min后达到平衡,NH3为2mol,NH3的转化率为20%.用NO的浓度变化表示该反应的平均反应速率为______,O2的平衡浓度为______;
(3)在达到平衡后,加入相当于原组成气体1倍的惰性气体.如果容器的体积不变,平衡______移动(填“正向”、“逆向”或“不”,下同),如果总压强保持不变,平衡______移动.
接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:2SO2(g)+O2(g)?2SO3(g);△H=-190KJ/mol
(1)该反应的平衡常数表达式是
(2)说明反应达到平衡状态是
a. V(O2)正=2V(SO3)逆 b.ひ(SO2)正?ひ(O2)逆=2:1
c.容器中气体的密度不随时间而变化 d.容器中气体的分子总数不随时间而变化
e.容器中气体的平均分子量不随时间而变化
(3)在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10molO2,半分钟后达到平衡,测得容器中含SO30.18mol,则V(O2)=
查看习题详情和答案>>
(1)该反应的平衡常数表达式是
K=
2
| [SO3] |
| [SO2]2[O2] |
K=
2
,该反应450℃时的平衡常数| [SO3] |
| [SO2]2[O2] |
大于
大于
500℃时的平衡常数(填“大于”、“小于”或“等于”).(2)说明反应达到平衡状态是
bde
bde
.a. V(O2)正=2V(SO3)逆 b.ひ(SO2)正?ひ(O2)逆=2:1
c.容器中气体的密度不随时间而变化 d.容器中气体的分子总数不随时间而变化
e.容器中气体的平均分子量不随时间而变化
(3)在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10molO2,半分钟后达到平衡,测得容器中含SO30.18mol,则V(O2)=
0.036
0.036
mol.L-1.min-1:若继续通入0.30mol SO2和0.15mol O2,则平衡向正反应方向
向正反应方向
移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,0.36
0.36
mol<n(SO3)<0.50
0.50
mol. 接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:2SO2(g)+O2(g)?2SO3(g)△H<0
(1)该反应450℃时的平衡常数
大于
大于
500℃时的平衡常数(填“大于”、“小于”或“等于”).(2)该化学达到平衡的标志是
b、d
b、d
.a.v(O2)正=2v( SO3)逆 b.容器中气体的平均分子量不随时间而变化
c.容器中气体的密度不随时间而变化 d.容器中气体的分子总数不随时间而变化
(3)恒温、密闭容器体系中充入一定量SO2、O2,反应达平衡时,某物理量随体系总压强(p)的关系如图所示所示.该物理量可能是
b、d
b、d
.a.平衡体系中SO2的体积分数
b.气体的平均相对分子质量
c.混合气体的密度
d.平衡体系中SO2的转化率
(4)在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10mol O2,半分钟后达到平衡,测得容器中含SO30.18mol,则v(O2)=
0.036
0.036
mol?L-1?min-1:若继续通入0.20mol SO2和0.10mol O2,则平衡向正反应方向
向正反应方向
移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,0.36
0.36
mol<n(SO3)<0.40
0.40
mol.(5)压强及温度对SO2转化率的影响如表(原料气各成分的体积分数为:SO27%;O21l%;N2 82%);
| 压强转化率温度 | 0.1MPa | 0.5MPa | 1MPa | 10MPa |
| 400℃ | 99.2% | 99.6% | 99.7% | 99.9% |
| 500℃ | 93.5% | 96.9% | 97.8% | 99.3% |
| 600℃ | 73.7% | 85.8% | 89.5% | 96.4% |
400℃~500℃
400℃~500℃
℃,压强0.1
0.1
MPa.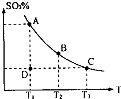 (1)在硫酸生产中,SO2催化氧化生成SO3是反应的关键,其反应的化学方程式为:2SO2(g)+O2(g)?2SO2(g),反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题:
(1)在硫酸生产中,SO2催化氧化生成SO3是反应的关键,其反应的化学方程式为:2SO2(g)+O2(g)?2SO2(g),反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题:①反应2SO2(g)+O2(g)?2SO2(g)的△H
②若温度为T1、T2,反应的平衡常数分别为K1K2 则K1
③在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10mol O2,在500℃开始反应,半分钟达到平衡,测得容器内含SO3 0.18mol,则v(O2)=
(2)已知三种无色溶液:a.NaHCO3溶液,b.AlCl3溶液,c.NaAlO2溶液,它们两两反应均能生成Al(OH)3沉淀.请回答下列问题:
①两种溶液恰好完全反应,所得溶液中c(OH-)=
| Kw |
②能体现出NaHCO3在反应中,HCO-3的水解程度小于电离程度的离于方程式为