网址:http://m.1010jiajiao.com/timu3_id_362480[举报]
(10分)为了测定实验室长期存放的Na2SO3固体的纯度,某化学活动小组设计了多种实验方案。准确称取W g固体样品,配成250mL溶液。分成三组进行实验:
甲组:量取25.00mL上述溶液,加入足量的盐酸酸化的BaCl2溶液,过滤、洗涤和干燥沉淀,称得沉淀的质量为m1g
乙组:量取25.00mL上述溶液,加入足量的盐酸酸化的Ba(NO3)2溶液,过滤、洗涤和干燥沉淀,称重,其质量为m2g
丙组:量取25.00mL上述溶液,用a mol/L 的酸性KMnO4溶液进行滴定。消耗KMnO4溶液b mL。
(1) 配制250mLNa2SO3溶液时,必须用到的实验仪器有:烧杯、玻棒、滴管和 。
(2) 在丙组实验中滴定时是否需要选择指示剂? (填“需要”或“不需要”)。滴定终点的颜色变化是 。
(3) 用丙组的实验数据,计算Na2SO3的纯度 。
(4) 实验中发现,乙组同学测定的Na2SO3纯度比甲组和丙组同学的结果都要低。试分析产生上述现象的原因 。
查看习题详情和答案>>
(10分)为了测定实验室长期存放的Na2SO3固体的纯度,某化学活动小组设计了多种实验方案。准确称取W g固体样品,配成250mL溶液。分成三组进行实验:
甲组:量取25.00mL上述溶液,加入足量的盐酸酸化的BaCl2溶液,过滤、洗涤和干燥沉淀,称得沉淀的质量为m1 g
乙组:量取25.00mL上述溶液,加入足量的盐酸酸化的Ba(NO3)2溶液,过滤、洗涤和干燥沉淀,称重,其质量为m2 g
丙组:量取25.00mL上述溶液,用a mol/L 的酸性KMnO4溶液进行滴定。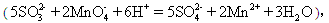 消耗KMnO4溶液b mL。
消耗KMnO4溶液b mL。
(1) 配制250mLNa2SO3溶液时,必须用到的实验仪器有:烧杯、玻棒、滴管和 。
(2) 在丙组实验中滴定时是否需要选择指示剂? (填“需要”或“不需要”)。滴定终点的颜色变化是 。
(3) 用丙组的实验数据,计算Na2SO3的纯度 。
(4) 实验中发现,乙组同学测定的Na2SO3纯度比甲组和丙组同学的结果都要低。试分析产生上述现象的原因 。
(10分)为了测定实验室长期存放的Na2SO3固体的纯度,某化学活动小组设计了多种实验方案。准确称取W g固体样品,配成250mL溶液。分成三组进行实验:
甲组:量取25.00mL上述溶液,加入足量的盐酸酸化的BaCl2溶液,过滤、洗涤和干燥沉淀,称得沉淀的质量为m1 g
乙组:量取25.00mL上述溶液,加入足量的盐酸酸化的Ba(NO3)2溶液,过滤、洗涤和干燥沉淀,称重,其质量为m2 g
丙组:量取25.00mL上述溶液,用a mol/L 的酸性KMnO4溶液进行滴定。 消耗KMnO4溶液b mL。
消耗KMnO4溶液b mL。
(1) 配制250mLNa2SO3溶液时,必须用到的实验仪器有:烧杯、玻棒、滴管和 。
(2) 在丙组实验中滴定时是否需要选择指示剂? (填“需要”或“不需要”)。滴定终点的颜色变化是 。
(3) 用丙组的实验数据,计算Na2SO3的纯度 。
(4) 实验中发现,乙组同学测定的Na2SO3纯度比甲组和丙组同学的结果都要低。试分析产生上述现象的原因 。
查看习题详情和答案>>
甲组:量取25.00mL上述溶液,加入足量的盐酸酸化的BaCl2溶液,过滤、洗涤和干燥沉淀,称得沉淀的质量为m1 g
乙组:量取25.00mL上述溶液,加入足量的盐酸酸化的Ba(NO3)2溶液,过滤、洗涤和干燥沉淀,称重,其质量为m2 g
丙组:量取25.00mL上述溶液,用a mol/L 的酸性KMnO4溶液进行滴定。
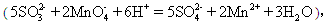 消耗KMnO4溶液b mL。
消耗KMnO4溶液b mL。(1) 配制250mLNa2SO3溶液时,必须用到的实验仪器有:烧杯、玻棒、滴管和 。
(2) 在丙组实验中滴定时是否需要选择指示剂? (填“需要”或“不需要”)。滴定终点的颜色变化是 。
(3) 用丙组的实验数据,计算Na2SO3的纯度 。
(4) 实验中发现,乙组同学测定的Na2SO3纯度比甲组和丙组同学的结果都要低。试分析产生上述现象的原因 。
Na2SO3在空气中易被氧化而变质。某同学为证明Na2SO3有还原性,从一瓶实验室长期存放的Na2SO3固体中取出少量溶于水,滴入一定量的烧碱溶液和少许溴水,振荡后溶液变为无色。
(1)在碱性溶液中Br2和Na2SO3反应的离子方程式 。
(2)反应后的溶液含有SO32-、SO42-、Br-、OH-等阴离子,下表是某同学鉴定其中SO32-、SO42-和Br-的实验报告,请完成未填完的部分。
限选试剂:2 mol·L-1HCl;1 mol·L-1 H2SO4;l mol·L-1BaCl2;l mol·L-1Ba(NO3)2;1 mol·L-1 KMnO4、CCl4;新制饱和氯水;品红溶液。
|
编号 |
实验操作 |
预期现象和结论 |
|
步骤①
|
取少量待测液加入试管中,加入过量2mol·L-1HCl,再滴加适量1 mol·L-1BaCl2 溶液。 |
有白色沉淀生成,证明待测液中含有、SO42- 。 |
|
步骤②
|
|
|
|
步骤③
|
|
|
(3)为了测定上述样品的纯度,现取10.0克试样配成250ml溶液。取出25.00ml所配溶液,用0.10mol/L的酸性KMnO4溶液滴定至终点。反应离子方程式为:
重复操作三次,每次消耗0.10mol/L KMnO4溶液体积分别为20.02 ml、 20.00 ml和19.98 ml。(相对原子质量Na 23 S 32 O 16)
①计算样品中Na2SO3的质量分数为 。(结果保留3位有效数字)
②操作时,若未用0.10mol/L的酸性KMnO4溶液润洗滴定管,会导致测定结果 。(填“偏高”、“偏低”或“没有影响”)
查看习题详情和答案>>