摘要:6.漂白粉在溶液中存在下列平衡体系:.以下措施能增强漂白粉的漂白效果的是 A.降低温度 B.加入大量的水 C.加入适量盐酸 D.加入适量烧碱溶液
网址:http://m.1010jiajiao.com/timu3_id_362427[举报]
(1)已知4g甲烷气体充分燃烧生成CO2(g)和H2O(l)时,放出Q kJ的热量.甲烷燃烧的热化学方程式为
(2)我国自行研制的优质磷酸二氢钾(KDP)晶体被应用于大功率固体激光器中.反应方程式为H3PO4(aq)+KCl(aq) KH2PO4(aq)+HCl(aq),当反应时间不同时,产品产率和产品中Cl?含量变化情况如图所示.KDP晶体的一级品标准:Cl-质量分数低于0.2%.
KH2PO4(aq)+HCl(aq),当反应时间不同时,产品产率和产品中Cl?含量变化情况如图所示.KDP晶体的一级品标准:Cl-质量分数低于0.2%.


由图中可知,当反应进行到约
(3)如图在一定条件下,将1mol N2与3mol H2混合于一个10L密闭容器中,反应达到A平衡时,混合气体中氨体积分数为25%,试回答:
①N2的转化率αA为
②在状态A时,平衡常数KA=
(mol/L)-2
(mol/L)-2(代入数值即可)当温度由T1变到T2时,KA
(4)向20.00mL稀氨水中逐滴加入等物质的量浓度的盐酸,请回答相关问题:
①当加入10.00mL盐酸时,溶液中各种离子浓度之间的大小关系为(请在括号中填入离子符号):c
②当盐酸与氨水等物质的量反应时,溶液的pH
③当溶液pH=7时,反应所消耗的物质(包括还在溶液中存留的物质)之间的关系为:n(NH3?H2O)
查看习题详情和答案>>
CH4(g)+2O2(g)=2H2O(l)+CO2(g)△H=-4QkJ?mol-1
CH4(g)+2O2(g)=2H2O(l)+CO2(g)△H=-4QkJ?mol-1
.(2)我国自行研制的优质磷酸二氢钾(KDP)晶体被应用于大功率固体激光器中.反应方程式为H3PO4(aq)+KCl(aq)
 KH2PO4(aq)+HCl(aq),当反应时间不同时,产品产率和产品中Cl?含量变化情况如图所示.KDP晶体的一级品标准:Cl-质量分数低于0.2%.
KH2PO4(aq)+HCl(aq),当反应时间不同时,产品产率和产品中Cl?含量变化情况如图所示.KDP晶体的一级品标准:Cl-质量分数低于0.2%.

由图中可知,当反应进行到约
60
60
min时,KDP晶体达到一级品标准,此时的产品产率约为95%
95%
.(3)如图在一定条件下,将1mol N2与3mol H2混合于一个10L密闭容器中,反应达到A平衡时,混合气体中氨体积分数为25%,试回答:
①N2的转化率αA为
40%
40%
;②在状态A时,平衡常数KA=
| 0.082 |
| 0.06×0.182 |
| 0.082 |
| 0.06×0.182 |
>
>
KB(填“>”、“<”或“=”);(4)向20.00mL稀氨水中逐滴加入等物质的量浓度的盐酸,请回答相关问题:
①当加入10.00mL盐酸时,溶液中各种离子浓度之间的大小关系为(请在括号中填入离子符号):c
(NH4+)
(NH4+)
>c(Cl-)
(Cl-)
>c(OH-)
(OH-)
>c(H+)
(H+)
②当盐酸与氨水等物质的量反应时,溶液的pH
<
<
7(填“>”或“<”或“=”,下同)③当溶液pH=7时,反应所消耗的物质(包括还在溶液中存留的物质)之间的关系为:n(NH3?H2O)
>
>
n(HCl),溶液中c( NH4+)=
=
c(Cl-).(2011?淄博二模)(1)向20.00mL稀氨水中逐滴加入等物质的量浓度的盐酸,请回答相关问题:
①当加入10.00mL盐酸时,溶液中各种离子浓度之间的大小关系为(请在括号中填入离子符号):c(
②当盐酸与氨水等物质的量反应时,溶液的pH
③当溶液pH=7时,反应所消耗的物质(包括还在溶液中存留的物质)之间的关系为:n(NH3?H2O)
(2)已知某弱酸的酸式酸根离子HB-既能发生电离,又能发生水解,请通过实验确定HB-离子是电离程度大还是水解程度大?请简述实验过程和结论.
查看习题详情和答案>>
①当加入10.00mL盐酸时,溶液中各种离子浓度之间的大小关系为(请在括号中填入离子符号):c(
NH4+
NH4+
)>c(Cl-
Cl-
)>c(OH-
OH-
)>c(H+
H+
)②当盐酸与氨水等物质的量反应时,溶液的pH
<
<
7(填“>”或“<”或“=”,下同)③当溶液pH=7时,反应所消耗的物质(包括还在溶液中存留的物质)之间的关系为:n(NH3?H2O)
>
>
n(HCl),溶液中c(NH4+)=
=
c(Cl-).(2)已知某弱酸的酸式酸根离子HB-既能发生电离,又能发生水解,请通过实验确定HB-离子是电离程度大还是水解程度大?请简述实验过程和结论.
用pH试纸测NaHB溶液的pH值.
用pH试纸测NaHB溶液的pH值.
若pH>7,说明HB-水解程度大于其电离程度;若pH=7,说明其水解程度等于其电离程度;如果pH<7,则说明其水解程度小于其电离程度.
若pH>7,说明HB-水解程度大于其电离程度;若pH=7,说明其水解程度等于其电离程度;如果pH<7,则说明其水解程度小于其电离程度.
. HClO + OH-,下列措施能提高漂白效果的是( )
HClO + OH-,下列措施能提高漂白效果的是( )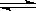 HClO
+ OH-,下列措施能提高漂白效果的是(
)
HClO
+ OH-,下列措施能提高漂白效果的是(
)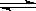 HClO+OH-,下列措施能提高其漂白效益的是(
)
HClO+OH-,下列措施能提高其漂白效益的是(
)