题目内容
(1)已知4g甲烷气体充分燃烧生成CO2(g)和H2O(l)时,放出Q kJ的热量.甲烷燃烧的热化学方程式为
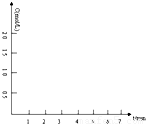
(2)我国自行研制的优质磷酸二氢钾(KDP)晶体被应用于大功率固体激光器中.反应方程式为H3PO4(aq)+KCl(aq) KH2PO4(aq)+HCl(aq),当反应时间不同时,产品产率和产品中Cl?含量变化情况如图所示.KDP晶体的一级品标准:Cl-质量分数低于0.2%.
KH2PO4(aq)+HCl(aq),当反应时间不同时,产品产率和产品中Cl?含量变化情况如图所示.KDP晶体的一级品标准:Cl-质量分数低于0.2%.


由图中可知,当反应进行到约
(3)如图在一定条件下,将1mol N2与3mol H2混合于一个10L密闭容器中,反应达到A平衡时,混合气体中氨体积分数为25%,试回答:
①N2的转化率αA为
②在状态A时,平衡常数KA=
(mol/L)-2
(mol/L)-2(代入数值即可)当温度由T1变到T2时,KA
(4)向20.00mL稀氨水中逐滴加入等物质的量浓度的盐酸,请回答相关问题:
①当加入10.00mL盐酸时,溶液中各种离子浓度之间的大小关系为(请在括号中填入离子符号):c
②当盐酸与氨水等物质的量反应时,溶液的pH
③当溶液pH=7时,反应所消耗的物质(包括还在溶液中存留的物质)之间的关系为:n(NH3?H2O)
CH4(g)+2O2(g)=2H2O(l)+CO2(g)△H=-4QkJ?mol-1
CH4(g)+2O2(g)=2H2O(l)+CO2(g)△H=-4QkJ?mol-1
.(2)我国自行研制的优质磷酸二氢钾(KDP)晶体被应用于大功率固体激光器中.反应方程式为H3PO4(aq)+KCl(aq)
 KH2PO4(aq)+HCl(aq),当反应时间不同时,产品产率和产品中Cl?含量变化情况如图所示.KDP晶体的一级品标准:Cl-质量分数低于0.2%.
KH2PO4(aq)+HCl(aq),当反应时间不同时,产品产率和产品中Cl?含量变化情况如图所示.KDP晶体的一级品标准:Cl-质量分数低于0.2%.

由图中可知,当反应进行到约
60
60
min时,KDP晶体达到一级品标准,此时的产品产率约为95%
95%
.(3)如图在一定条件下,将1mol N2与3mol H2混合于一个10L密闭容器中,反应达到A平衡时,混合气体中氨体积分数为25%,试回答:
①N2的转化率αA为
40%
40%
;②在状态A时,平衡常数KA=
| 0.082 |
| 0.06×0.182 |
| 0.082 |
| 0.06×0.182 |
>
>
KB(填“>”、“<”或“=”);(4)向20.00mL稀氨水中逐滴加入等物质的量浓度的盐酸,请回答相关问题:
①当加入10.00mL盐酸时,溶液中各种离子浓度之间的大小关系为(请在括号中填入离子符号):c
(NH4+)
(NH4+)
>c(Cl-)
(Cl-)
>c(OH-)
(OH-)
>c(H+)
(H+)
②当盐酸与氨水等物质的量反应时,溶液的pH
<
<
7(填“>”或“<”或“=”,下同)③当溶液pH=7时,反应所消耗的物质(包括还在溶液中存留的物质)之间的关系为:n(NH3?H2O)
>
>
n(HCl),溶液中c( NH4+)=
=
c(Cl-).分析:(1)利用4g甲烷与热量的关系计算反应热,根据物质及物质的状态、反应热来书写热化学反应方程式;
(2)根据KDP晶体的一级品标准:Cl-质量分数低于0.2%,利用图象来分析;
(3)利用氨气的体积分数及化学平衡的三段法计算来解答;并利用图象判断温度对化学平衡移动的影响来分析温度变化引起的K的变化;
(4)①由量可知,反应后为等量的氨水和氯化铵的混合溶液,溶液显碱性及氨水的电离大于氯化铵的水解来分析;
②当盐酸与氨水等物质的量反应,溶液中的溶质只有氯化铵,则利用水解来分析;
③溶液pH=7时,溶液应为氨水和氯化铵的混合溶液,即氨水的电离等于氯化铵的水解,利用电荷守恒来分析.
(2)根据KDP晶体的一级品标准:Cl-质量分数低于0.2%,利用图象来分析;
(3)利用氨气的体积分数及化学平衡的三段法计算来解答;并利用图象判断温度对化学平衡移动的影响来分析温度变化引起的K的变化;
(4)①由量可知,反应后为等量的氨水和氯化铵的混合溶液,溶液显碱性及氨水的电离大于氯化铵的水解来分析;
②当盐酸与氨水等物质的量反应,溶液中的溶质只有氯化铵,则利用水解来分析;
③溶液pH=7时,溶液应为氨水和氯化铵的混合溶液,即氨水的电离等于氯化铵的水解,利用电荷守恒来分析.
解答:解:(1)4g甲烷的物质的量为
=0.25mol,放出QkJ的热量,
则1molCH4反应放热为4QkJ,则热化学方程式为CH4(g)+2O2(g)=2H2O(l)+CO2(g)△H=-4Q kJ?mol-1,
故答案为:CH4(g)+2O2(g)=2H2O(l)+CO2(g)△H=-4Q kJ?mol-1;
(2)因KDP晶体的一级品标准:Cl-质量分数低于0.2%,黑球表示产品产率,方框表示氯离子的质量分数,
由图象可以看出,60min时Cl-质量分数低于0.2%,则为一级品,且产品产率为95%,故答案为:60;95%;
(3)1mol N2与3mol H2混合于一个10L密闭容器中,反应达到A平衡时,混合气体中氨体积分数为25%,
设转化的氮气的物质的量为x,则
N2+3H2
2NH3,
开始 1 3 0
转化 x 3x 2x
平衡 1-x 3-3x 2x
则
×100%=25%,
解得x=0.4mol,
①N2的转化率αA为
×100%=40%,
②氮气的平衡浓度为
=0.06mol/L,
氢气的平衡浓度为
=0.18mol/L,
氨气的平衡浓度为
=0.08(mol/L),
则平衡常数K=
(mol/L)-2,由图象可知,温度越高氮气的转化率越低,则正反应为放热反应,
当温度由T1变到T2时,K变小,即KA>KB,
故答案为:40%;
(mol/L)-2;>;
(4)①由量可知,反应后为等量的氨水和氯化铵的混合溶液,电离大于水解,则c(NH4+)>c(Cl-),溶液显碱性,
则c( OH-)>c(H+),又电离的程度很弱,则c(NH4+)>c(Cl-)>c( OH-)>c(H+),
故答案为:(NH4+);(Cl-);( OH-);(H+);
②盐酸与氨水等物质的量反应,溶液中的溶质只有氯化铵,则铵根离子水解使溶液显酸性,则pH<7,故答案为:<;
③pH=7时,溶液应为氨水和氯化铵的混合溶液,且氨水的电离等于氯化铵的水解,因二者的物质的量浓度相同,等体积混合溶液的pH小于7,则应保证碱过量,则氨水的体积大,即
n(NH3?H2O)>n(HCl),pH=7时c( OH-)=c(H+),
由电荷守恒则c(NH4+)+c(H+)=c(Cl-)+c OH-);,则c(NH4+)=c(Cl-),故答案为:>;=.
| 4g |
| 16g/mol |
则1molCH4反应放热为4QkJ,则热化学方程式为CH4(g)+2O2(g)=2H2O(l)+CO2(g)△H=-4Q kJ?mol-1,
故答案为:CH4(g)+2O2(g)=2H2O(l)+CO2(g)△H=-4Q kJ?mol-1;
(2)因KDP晶体的一级品标准:Cl-质量分数低于0.2%,黑球表示产品产率,方框表示氯离子的质量分数,
由图象可以看出,60min时Cl-质量分数低于0.2%,则为一级品,且产品产率为95%,故答案为:60;95%;
(3)1mol N2与3mol H2混合于一个10L密闭容器中,反应达到A平衡时,混合气体中氨体积分数为25%,
设转化的氮气的物质的量为x,则
N2+3H2
| 催化剂 |
开始 1 3 0
转化 x 3x 2x
平衡 1-x 3-3x 2x
则
| 2x |
| 1-x+3-3x+2x |
解得x=0.4mol,
①N2的转化率αA为
| 0.4mol |
| 1mol |
②氮气的平衡浓度为
| 1mol-0.4mol |
| 10L |
氢气的平衡浓度为
| 1.8mol |
| 10L |
氨气的平衡浓度为
| 0.8mol |
| 10L |
则平衡常数K=
| 0.082 |
| 0.06×0.182 |
当温度由T1变到T2时,K变小,即KA>KB,
故答案为:40%;
| 0.082 |
| 0.06×0.182 |
(4)①由量可知,反应后为等量的氨水和氯化铵的混合溶液,电离大于水解,则c(NH4+)>c(Cl-),溶液显碱性,
则c( OH-)>c(H+),又电离的程度很弱,则c(NH4+)>c(Cl-)>c( OH-)>c(H+),
故答案为:(NH4+);(Cl-);( OH-);(H+);
②盐酸与氨水等物质的量反应,溶液中的溶质只有氯化铵,则铵根离子水解使溶液显酸性,则pH<7,故答案为:<;
③pH=7时,溶液应为氨水和氯化铵的混合溶液,且氨水的电离等于氯化铵的水解,因二者的物质的量浓度相同,等体积混合溶液的pH小于7,则应保证碱过量,则氨水的体积大,即
n(NH3?H2O)>n(HCl),pH=7时c( OH-)=c(H+),
由电荷守恒则c(NH4+)+c(H+)=c(Cl-)+c OH-);,则c(NH4+)=c(Cl-),故答案为:>;=.
点评:本题较难,考查有关化学平衡的计算、溶液中离子浓度大小的关系、热化学方程式及图形的分析,综合性强,能较好的训练学生的能力.

练习册系列答案
相关题目
 合成气(CO和H2)是重要的化工原料,在工业生产中有着广泛的应用.
合成气(CO和H2)是重要的化工原料,在工业生产中有着广泛的应用.