网址:http://m.1010jiajiao.com/timu3_id_362000[举报]
| |||||||||||||||||||||||
某化学兴趣小组在课外活动中,对某溶液进行了三次检验,每次检验结果如下表所示,请回答下列问题.
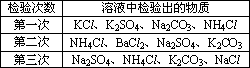
(1)三次检验结果中第________次检验结果不正确.
(2)检验时,为了证明溶液中存在SO![]() 、Cl-、CO
、Cl-、CO![]() ,进行下列实验:
,进行下列实验:
第一步,向溶液中滴加________(填化学式)溶液,其目的是________;
第二步,继续加入过量的________(填化学式)溶液,其目的是________;
第三步:向溶液中滴加________(填化学式)溶液,其目的是________;
第四步:过滤,再向滤液中加入________(填化学式)溶液,其目的是________;
(3)为了确定NH![]() 的存在,写出鉴定NH
的存在,写出鉴定NH![]() 的实验方法和现象:________
的实验方法和现象:________
有一包白色粉末,它是由KCl、 和
和 中的两种物质混合而成的,现进行下述实验:
中的两种物质混合而成的,现进行下述实验:
第一步:将白色粉末和熟石灰混合研磨,能放出气体,此气体可使湿红石蕊试纸变蓝;
第二步:另取少量白色粉末,加足量水并充分搅拌,有白色沉淀存在,过滤分离,该沉淀不溶于硝酸;
第三步:向上述分离所得澄清滤液里加入硝酸银溶液,又有白色沉淀产生,再加硝酸.沉淀不消失.
可知这包粉末是由________和________混合而成的,写出三步实验的化学方程式:
第一步:________________________;
第二步:________________________;
第三步:________________________.
查看习题详情和答案>>(1)第一步:查阅资料得知,双氧水可以氧化SCN-生成N2、CO2和SO42-,也可以将Fe2+氧化成Fe3+.
(2)第二步:向去掉糖衣、研磨好的药品中加稀盐酸,出现淡绿色浑浊液,说明有
(3)第三步:往上述溶液中滴入几滴KSCN溶液,出现浅红色,说明溶液中有少量Fe3+离子存在.该离子存在的原因可能是(填序号):
①药品中的铁本来就是以三价铁的形式存在;
②在制药过程中生成少量三价铁;
③本实验过程中有少量三价铁生成.
(4)第四步:将第三步所得溶液分成2份,分别装在A、B两个试管中.
(5)第五步:向A试管的溶液中加入少量稀硫酸,再慢慢滴入过量的H2O2溶液,溶液的红色先变深,之后红色逐渐褪去.
①红色变深的原因是(用离子方程式表示):
②溶液红色又褪去的原因可能是:
③请自选中学实验室中常用仪器、药品,设计实验证明溶液红色褪去的原因:
(6)第六步:向B试管的溶液中加入一片Vc片,片刻后溶液红色也褪去,说明Vc有
 铝是一种重要的金属,在生产、生活中具有许多重要的用途,如图是从铝土矿中制备铝的工艺流程:
铝是一种重要的金属,在生产、生活中具有许多重要的用途,如图是从铝土矿中制备铝的工艺流程:已知:①铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
②溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学反应方程式为2Na2SiO3+2NaAlO2+2H2O═Na2Al2Si2O8↓+4NaOH
回答下列问题:
(1)写出向铝土矿中加入足量氢氧化钠溶液操作中发生反应的离子方程式:
(2)滤渣A的主要成分为
(3)在工艺流程第三步中,选用二氧化碳作酸化剂的原因是
(4)若将铝溶解,下列试剂中最好选用
A.浓硫酸 B.稀硫酸 C.稀硝酸.
 I3-,可用Na2S2O3标准溶液滴定,其反应为:2S2O32-+I3-=S4O62-+3I-.
I3-,可用Na2S2O3标准溶液滴定,其反应为:2S2O32-+I3-=S4O62-+3I-.