网址:http://m.1010jiajiao.com/timu3_id_361970[举报]
某学校同学进行乙醇的化学性质实验探究学习,以下为他们的学习过程。
(一)结构分析
(1)写出乙醇的结构式 ;官能团的电子式 。
(二)性质预测
(2)对比乙醇和乙烷的结构,经过讨论,同学们认为乙醇分子中氧原子吸引电子能力较强,预测在一定条件下分子中 键(填写具体共价键)容易发生断裂。为此,他们查阅了相关资料,获得了以下乙醇性质的部分事实。
|
下列关于乙醇结构和性质的分析、理解错误的是
A.-OH对-C2H5的影响使乙醇与钠的反应比水与钠的反应速率慢ks5u
B. 乙醇在浓硫酸催化下,170℃时脱水生成乙烯的反应为消去反应
C. 乙醇的核磁共振氢谱图上有3个吸收峰,其强度之比为3︰2︰1,与钠反应的是
吸收强度最小的氢原子
 D. 乙醇与甲醚互为官能团异构体
D. 乙醇与甲醚互为官能团异构体
(三)设计方案、进行实验
甲同学用4mL 95%的乙醇、8mL90%浓硫酸、
6g溴化钠研究乙醇转化为溴乙烷的反应。右图
是他设计的实验装置图(已省略部分夹持仪器)。
请回答有关问题。
(3)预计实验时装置Ⅰ主要发生两个反应,写出反应②的化学方程式。
![]() ①2NaBr + H2SO4 2HBr + Na2SO4,
①2NaBr + H2SO4 2HBr + Na2SO4,
②
(4)实验过程中,观察到反应后期烧瓶内液体颜色变棕黑,U形管右边与大气相通的导管口产生大量有刺激性气味的白雾,U形管内有少量淡黄色液体,该液体的有机成分是 。若要获得纯净的溴乙烷,方法是:实验结束后 。
(四)反思与改进
(5)乙同学认为:实验所用浓硫酸必须进行稀释,目的是 (填字母),稀释后的浓硫酸应放在 (填实验仪器名称)中。
A.减少HBr的挥发 B.防止浓硫酸分解产生SO2
C.减少副产物乙烯和乙醚的生成 D.减少Br2的生成
(6)丙同学提出应该对实验装置进行改进,请为两部分装置选择正确的措施:
A.不作改变 B.保留酒精灯加热,增加温度计且温度计水银球插入反应液中
C.水浴加热 D.冰水混合物冷却
装置Ⅰ ;装置Ⅱ 。请你再提出一条改进措施 。
查看习题详情和答案>>为测定碳酸钙粉末的纯度(含杂质SiO2),某学校学生设计了如下几个实验方案:
方案一:①称取碳酸钙样品M g;②加入过量盐酸;③收集并测定生成的气体体积V mL。
方案二:①称取碳酸钙样品M g;②用c mol/L盐酸V mL(过量)溶解样品;③取溶解后的溶液用c′mol/L NaOH溶液滴定,恰用去V′ mL。
方案三:①称取碳酸钙样品M g;②高温1000 ℃煅烧直至质量不再改变,冷却后称量,质量为M′ g。
方案四:①称取碳酸钙样品M g;②加入足量c mol/L盐酸V mL使之完全溶解;③过滤并取滤液;④在滤液中加入过量的c′mol/L Na2CO3溶液V′mL;⑤将步骤④中的沉淀滤出,洗涤、干燥、称量为M′g。
依据以上实验方案回答以下问题:
(1)方案一中如果称量样品时,砝码底部有一处未被发现的残缺,那么测得的碳酸钙纯度会________(填“偏高”、“偏低”或“无影响”)。
(2)方案二中:列出本实验中所用到的仪器名称(除铁架台、烧杯、铁架台附件外)_________________________________________________________________________。
(3)方案三中的“冷却”应如何操作:
____________________________________________________________;
理由是_________________________________________________________。
(4)方案四中计算碳酸钙纯度的公式为______________;步骤⑤中要将沉淀进行洗涤,如果未经洗涤,则测定结果碳酸钙纯度将________(填“偏高”、“偏低”或“无影响”)。
(5)综上所述,请从实验条件的难易、操作引起实验误差的大小等方面进行综合判断,你认为四个方案中,最好的方案是________。其他方案的缺点分别是:
方案四:沉淀的洗涤、干燥、称量操作过程复杂,容易造成较大误差。
方案________:_____________________________________________________。
方案________:____________________________________________________。
查看习题详情和答案>>
方案Ⅰ:①称取碳酸钙样品M g;②加入过量盐酸;③收集并测定生成的气体体积V mL。
方案Ⅱ:①称取碳酸钙样品M g;②用c mol·L-1?盐酸V mL(过量)溶解样品;③取溶解后的溶液用c′ mol·L-1 NaOH溶液滴定,恰用去V′ mL。
方案Ⅲ:①称取碳酸钙样品M g;②高温煅烧1
方案Ⅳ:①称取碳酸钙样品Mg;②加入足量c mol·L-1盐酸V mL使完全溶解;③过滤并取滤液;④在滤液中加入过量c′ mol·L-1 Na2CO3溶液V′ mL;⑤将步骤④中的沉淀滤出,洗涤、干燥、称量为M′ g。
依据以上实验方案回答以下问题:
(1)方案Ⅰ中如果称量样品时,砝码底部有一处未被人发现的残缺,那么测得的碳酸钙纯度会____________(填“偏高”“偏低”或“无影响”)。
(2)方案Ⅱ中:列出本实验中所用到的仪器名称(除铁架台、烧杯、铁架台附件外)____________________________________________________________________。
(3)方案Ⅲ中的“冷却”应如何操作:_________________________________________;理由是__________________________________________________________________。
(4)方案Ⅳ中计算碳酸钙纯度的公式为_____________;步骤⑤中要将沉淀进行洗涤,如果未经洗涤,则测定结果,碳酸钙纯度将_____________(填“偏高”“偏低”或“无影响”)。
(5)综上所述,请从实验条件的难易、操作引起实验误差的大小等方面进行综合判断,你认为四个方案中,最好的方案是_____________。其他方案的缺点分别是:
方案Ⅳ:沉淀的洗涤、干燥、称量操作过程复杂,容易造成较大误差。
方案:__________:___________________________________________________。
方案:__________:___________________________________________________。
查看习题详情和答案>>本题包括两个小题,共16 分。
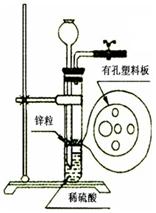
Ⅰ.某同学在实验室里利用一定量的Zn按右图所示的装置制取一定量的H2。在实验中他发现稀硫酸溶液不足而再无其他酸溶液可加入,经仔细思考后他通过长颈漏斗加入适量的某试剂完成了实验。下列试剂中他不可能选用的是(填写代码) 。
A.KCl溶液 B.酒精 C.苯 D.四氯化碳
Ⅱ.有甲、乙两学生分别按下面的步骤探究问题:在物质发生化学变化的前后,其总
质量是否发生增加或者减小或者不变?
(1)提出假设:物质发生化学变化的前后,其总质量不变。
(2)设计方案并进行实验:甲设计的实验装置和选用药品如下图A所示,乙设计的实验装置和
选用药品如下图B所示,他们在反应前后都进行了规范的操作、准确的称量和细致的观察。
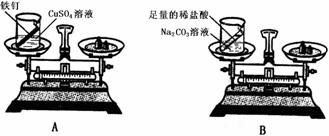
①实验结论:
甲认为:在化学反应中,生成物的总质量与反应物的总质量相等;
乙认为:在化学反应中,生成物总质量与反应物总质量不相等。
②你认为 的结论正确。
③请从宏观的角度分析你认为正确的结论的原因 ;
④请从微观的角度分析你认为正确的结论的原因 ;
⑤请写出上述实验中有关反应的离子方程式
A ,B 。
查看习题详情和答案>>本题包括两个小题,共16 分。
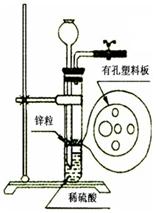
Ⅰ.某同学在实验室里利用一定量的Zn按右图所示的装置制取一定量的H2。在实验中他发现稀硫酸溶液不足而再无其他酸溶液可加入,经仔细思考后他通过长颈漏斗加入适量的某试剂完成了实验。下列试剂中他不可能选用的是(填写代码) 。
A.KCl溶液 B.酒精 C.苯 D.四氯化碳
Ⅱ.有甲、乙两学生分别按下面的步骤探究问题:在物质发生化学变化的前后,其总
质量是否发生增加或者减小或者不变?
(1)提出假设:物质发生化学变化的前后,其总质量不变。
(2)设计方案并进行实验:甲设计的实验装置和选用药品如下图A所示,乙设计的实验装置和
选用药品如下图B所示,他们在反应前后都进行了规范的操作、准确的称量和细致的观察。
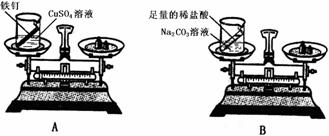
①实验结论:
甲认为:在化学反应中,生成物的总质量与反应物的总质量相等;
乙认为:在化学反应中,生成物总质量与反应物总质量不相等。
②你认为 的结论正确。
③请从宏观的角度分析你认为正确的结论的原因 ;
④请从微观的角度分析你认为正确的结论的原因 ;
⑤请写出上述实验中有关反应的离子方程式
A ,B 。
查看习题详情和答案>>