题目内容
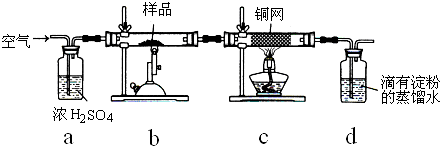
为测定碳酸钙粉末的纯度(含杂质SiO2),某学校学生设计了如下几个实验方案:
方案一:①称取碳酸钙样品M g;②加入过量盐酸;③收集并测定生成的气体体积V mL。
方案二:①称取碳酸钙样品M g;②用c mol/L盐酸V mL(过量)溶解样品;③取溶解后的溶液用c′mol/L NaOH溶液滴定,恰用去V′ mL。
方案三:①称取碳酸钙样品M g;②高温1000 ℃煅烧直至质量不再改变,冷却后称量,质量为M′ g。
方案四:①称取碳酸钙样品M g;②加入足量c mol/L盐酸V mL使之完全溶解;③过滤并取滤液;④在滤液中加入过量的c′mol/L Na2CO3溶液V′mL;⑤将步骤④中的沉淀滤出,洗涤、干燥、称量为M′g。
依据以上实验方案回答以下问题:
(1)方案一中如果称量样品时,砝码底部有一处未被发现的残缺,那么测得的碳酸钙纯度会________(填“偏高”、“偏低”或“无影响”)。
(2)方案二中:列出本实验中所用到的仪器名称(除铁架台、烧杯、铁架台附件外)_________________________________________________________________________。
(3)方案三中的“冷却”应如何操作:
____________________________________________________________;
理由是_________________________________________________________。
(4)方案四中计算碳酸钙纯度的公式为______________;步骤⑤中要将沉淀进行洗涤,如果未经洗涤,则测定结果碳酸钙纯度将________(填“偏高”、“偏低”或“无影响”)。
(5)综上所述,请从实验条件的难易、操作引起实验误差的大小等方面进行综合判断,你认为四个方案中,最好的方案是________。其他方案的缺点分别是:
方案四:沉淀的洗涤、干燥、称量操作过程复杂,容易造成较大误差。
方案________:_____________________________________________________。
方案________:____________________________________________________。
(1)偏低
(2)托盘天平、药匙、滴定管夹、酸式滴定管、碱式滴定管、锥形瓶、玻璃棒
(3)在干燥器中冷却 防止生成的氧化钙与空气中的水蒸气反应,造成质量改变而产生误差
(4)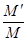 ×100% 偏高
×100% 偏高
(5)方案二 一 气体体积难以测量准确,气体体积受外界影响太大 三 实验温度高(1000 ℃的高温),对实验条件要求较高
【解析】
试题分析:(1)砝码底部有残缺,则所称样品的质量偏小,通过实验所测得的二氧化碳的体积偏小,即所测的碳酸钙样品纯度偏低;(2)称取碳酸钙样品需要托盘天平和药匙,量取盐酸用酸式滴定管,用盐酸溶解样品时需要烧杯和玻璃棒,用氢氧化钠溶液滴定需要铁架台、滴定管夹、碱式滴定管、锥形瓶等仪器;(3)碳酸钙分解产物固体是氧化钙,因氧化钙会吸收空气中的水蒸气,故必须在干燥器中冷却;(4)碳酸钙样品与盐酸反应后,将不溶性的杂质过滤除去,在滤液中加入过量的碳酸钠溶液,形成碳酸钙沉淀,如果未洗涤,干燥后,固体上残留氯化钠,则所得碳酸钙的纯度偏高;计算公式为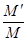 ×100%;(5)从实验条件的难易和操作引起的实验误差大小综合判断,四个方案中最好的是方案二。方案一的缺点是气体的体积难以测量,另外气体的体积受温度和压强的影响;方案三的缺点是加热所需的温度太高。
×100%;(5)从实验条件的难易和操作引起的实验误差大小综合判断,四个方案中最好的是方案二。方案一的缺点是气体的体积难以测量,另外气体的体积受温度和压强的影响;方案三的缺点是加热所需的温度太高。
考点:考查实验基本操作、仪器的选择、物质含量的计算以及实验误差分析
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养和训练,有利于培养学生规范严谨的实验设计、操作能力。该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。

 名校课堂系列答案
名校课堂系列答案为测定镁带的纯度,可通过测定镁带与稀硫酸反应生成气体的体积后再进行计算。
(1)用电子天平准确称取纯净的镁带18.000 g,并将其投入到足量的稀硫酸中。完全反应后,在标准状况下可收集到气体__________L。
(2)若镁带中含有锌或铝中的一种杂质。现称取相同的样品进行实验,测得的气体体积(已换算到标准状况)数据列表如下:
| 实验次数 | 镁带质量(g) | 测得气体的体积(L) |
| 1 | 18.000 | 16.90 |
| 2 | 18.000 | 17.00 |
(3)利用测得的数据求镁带的纯度。
为测定镁带的纯度,可通过测定镁带与稀硫酸反应生成气体的体积后再进行计算。
(1)用电子天平准确称取纯净的镁带18.000 g,并将其投入到足量的稀硫酸中。完全反应后,在标准状况下可收集到气体__________L。
(2)若镁带中含有锌或铝中的一种杂质。现称取相同的样品进行实验,测得的气体体积(已换算到标准状况)数据列表如下:
|
实验次数 |
镁带质量(g) |
测得气体的体积(L) |
|
1 |
18.000 |
16.90 |
|
2 |
18.000 |
17.00 |
测得气体体积的平均值是___________。据此分析,测得的结果比同质量的纯镁产生的气体体积_________(填“多”、“少”或“无影响”)。其原因是含有杂质__________(填“锌”或“铝”)。
(3)利用测得的数据求镁带的纯度。