摘要:38.4mg Cu与适量的浓HNO3反应.Cu全部反应后.共收集到22.4ml气体.反应消耗的HNO3物质的量可能是( ) A.1.0×10-3mol B.1.6×10-3mol C.2.2×10-3mol D.2.4×10-3mol 本题涉及知识点为硝酸的化学性质.题中的反应是一个动态过程.考察了学生综合思维能力 .
网址:http://m.1010jiajiao.com/timu3_id_361708[举报]
38.4mg Cu与适量的硝酸反应,铜全部作用后,共收集到气体22.4mL(标况),反应消耗的硝酸物质的量是
[ ]
A.1.0×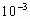 mol
mol
B.1.6×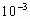 mol
mol
C.2.2×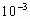 mol
mol
D.2.4×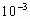 mol
mol
(2012?大兴区一模)某学习小组为研究低价态氮元素物质的还原性,以NH3为例设计了如下图实验(夹持设备略去)

Ⅰ.检验气密性后关闭弹簧夹I打开弹簧夹Ⅱ,点燃酒精灯,铜丝红热后打开分液漏斗的活塞,A中气体进入B中时不断通入空气,反应一段时间后熄灭酒精灯.
Ⅱ.(1)能证明有氨气产生的现象是
 .
.
(2)C中铜丝在熄灭酒灯后仍保持红热说明其中反应为
(3)D中产生红棕色气体和白烟,产生白烟的化学方程式为:
(4)F中也产生大量白烟,写出该反应中反应物的物质的量之比n(NH3):n(Cl2)
(5)用化学方程式及相应理论说明A中能产生大量NH3气体的原因
(6)装置中A稍有不足,应该怎样改进
(7)C中铜丝可以与H2O2和H2SO4的混合溶液发生化学反应,已知:
Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)H=64.39KJ?mol-1
2H2O2(l)═2H2O(l)+O2(g)H=-196.46KJ?mol-1
H2(g)+
O2(g)═H2O(l)H=-285.84KJ?mol-1
写出在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式
查看习题详情和答案>>

Ⅰ.检验气密性后关闭弹簧夹I打开弹簧夹Ⅱ,点燃酒精灯,铜丝红热后打开分液漏斗的活塞,A中气体进入B中时不断通入空气,反应一段时间后熄灭酒精灯.
Ⅱ.(1)能证明有氨气产生的现象是
A中湿润的红色石蕊试纸变蓝
A中湿润的红色石蕊试纸变蓝
;氨分子电子式为

(2)C中铜丝在熄灭酒灯后仍保持红热说明其中反应为
放
放
热反应(填“吸热”或“放热”NH3在C中反应的化学方程式为4NH3+5O2
4NO+6H2O,2NH3+3CuO
3Cu+N2+3H2O
| ||
| △ |
| ||
| △ |
4NH3+5O2
4NO+6H2O,2NH3+3CuO
3Cu+N2+3H2O
.
| ||
| △ |
| ||
| △ |
(3)D中产生红棕色气体和白烟,产生白烟的化学方程式为:
HNO3+NH3=NH4NO3
HNO3+NH3=NH4NO3
(4)F中也产生大量白烟,写出该反应中反应物的物质的量之比n(NH3):n(Cl2)
8:3
8:3
(5)用化学方程式及相应理论说明A中能产生大量NH3气体的原因
NH3+H2O?NH3.H2O?NH4++OH-△H<0,氢氧化钠使c(OH-)增大,平衡逆向移动,同时氢氧化钠溶于水放出大量热,也使平衡逆向移动,产生大量氨气
NH3+H2O?NH3.H2O?NH4++OH-△H<0,氢氧化钠使c(OH-)增大,平衡逆向移动,同时氢氧化钠溶于水放出大量热,也使平衡逆向移动,产生大量氨气
,比较某时刻A中分液漏斗溶液平衡常数K1和三颈瓶中溶液的平衡常数K2大小关系,K1>
>
K2(填“<”“=”“>”).(6)装置中A稍有不足,应该怎样改进
装置中A装置分液漏斗与三颈瓶之间增加一气压平衡管
装置中A装置分液漏斗与三颈瓶之间增加一气压平衡管
.(7)C中铜丝可以与H2O2和H2SO4的混合溶液发生化学反应,已知:
Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)H=64.39KJ?mol-1
2H2O2(l)═2H2O(l)+O2(g)H=-196.46KJ?mol-1
H2(g)+
| 1 |
| 2 |
写出在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式
Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.68KJ.mol-1
Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.68KJ.mol-1
.(1)向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH=1,则水电离出来的c(H+)=
(2)25℃下,向浓度均为0.1mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成
(3)在25℃下,将a mol?L-1的HA与0.01mol?L-1的氢氧化钠溶液等体积混合,反应平衡时溶液中c(Na+)=c(A-),则溶液显
.
(4)在1mol?L-1CuSO4溶液中含有少量的Fe3+ 杂质,pH值控制在
查看习题详情和答案>>
10-11 mol/L
10-11 mol/L
.(2)25℃下,向浓度均为0.1mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成
Cu(OH)2
Cu(OH)2
沉淀(填化学式),滴加氨水至过量,部分沉淀溶解的离子方程式为Cu2++2NH3?H2O?Cu(OH)2↓+2NH4+
Cu2++2NH3?H2O?Cu(OH)2↓+2NH4+
.已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=4.0×10-18(3)在25℃下,将a mol?L-1的HA与0.01mol?L-1的氢氧化钠溶液等体积混合,反应平衡时溶液中c(Na+)=c(A-),则溶液显
中
中
性(填“酸”、“碱”或“中”);用含a的代数式表示HA的电离常数Ka=| 10-9 |
| a-0.01 |
| 10-9 |
| a-0.01 |
(4)在1mol?L-1CuSO4溶液中含有少量的Fe3+ 杂质,pH值控制在
3.3
3.3
才能除去Fe3+ 而Cu2+仍为1mol?L-1 (当溶液中c(Fe3+)≤10-5mol?L-1时一般认为该离子已除尽).(已知某温度下Fe(OH)3的 Ksp=8.0×10-38,Cu(OH)2 的Ksp=4.0×10-18,lg2=0.3).⑴向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH=1,
则水电离出来的c(H+)=__▲ 。
(2)25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 ▲ (沉淀填化学式),滴加氨水至过量,部分沉淀溶解的离子方程式为 ▲ 。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]= 4.0×10-18
(3)在25 ℃下,将a mol·L-1的HA与0.01 mol·L-1的氢氧化钠溶液等体积混合,反应平衡时溶液中c(Na+)=c(A-),则溶液显___▲_____性(填“酸”、“碱”或“中”);用含a的代数式表示HA的电离常数Ka=______▲__________。
(4)在1mol·L-1CuSO4溶液中含有少量的Fe3+ 杂质,pH值控制在 ▲ 才能除去Fe3+ 而Cu2+仍为1mol·L-1 (当溶液中c(Fe3+) ≤ 10-5mol·L-1时一般认为该离子已除尽)。
(已知某温度下Fe(OH)3的 Ksp = 8.0×10-38 , Cu(OH)2 的Ksp= 4.0×10-18 , lg2=0.3)。
查看习题详情和答案>>