摘要:15.下列微粒为正四面体构型的离子是 A.P4 B.H3O+ C.CH3Cl D.NH4+
网址:http://m.1010jiajiao.com/timu3_id_361654[举报]
(物质结构)下表中实线是元素周期表的部分边界,其中上边界并未用实线标出.
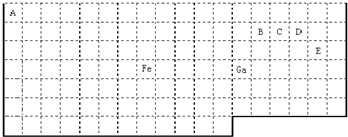
根据信息回答下列问题:
(1)周期表中基态Ga原子的最外层电子排布式为
(2)Fe元素位于周期表的
(3)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有
(4)根据VSEPR理论预测ED4-离子的空间构型为
 (写3种)
(写3种)
查看习题详情和答案>>

根据信息回答下列问题:
(1)周期表中基态Ga原子的最外层电子排布式为
4s24p1
4s24p1
.(2)Fe元素位于周期表的
d
d
分区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为0
0
;已知:原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征.与CO分子互为等电子体的分子和离子分别为N2
N2
和CN-
CN-
(填化学式).(3)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有
CH4CH3OH
CH4CH3OH
.(4)根据VSEPR理论预测ED4-离子的空间构型为
正四面体
正四面体
型.B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的电子式为:
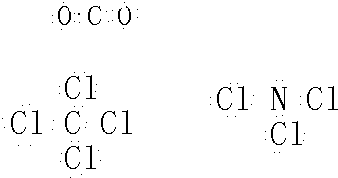
(1)第ⅢA、ⅤA元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似.Ga原子的电子排布式为
(2)铜、铁元素能形成多种配合物.微粒间形成配位键的条件是:一方是能够提供孤电子对的原子或离子,另一方是具有
(3)CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子:请回答下列问题:

①H、N、O三种元素的电负性由大到小的顺序是
②SO2分子的空间构型为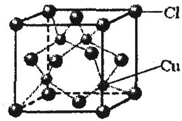
③乙二胺分子中氮原子轨道的杂化类型为
④(3)中所形成的配离子中含有的化学键类型有
a.配位键 b.极性键 c.离子键 d.非极性键
⑤CuCl的晶胞结构如图所示,其中Cl原子的配位数为
查看习题详情和答案>>
1s22s22p63s23p63d104s24p1
1s22s22p63s23p63d104s24p1
.在GaN晶体中,与同一个Ga原子相连的N原子构成的空间构型为正四面体
正四面体
.在四大晶体类型中,GaN属于原子
原子
晶体.(2)铜、铁元素能形成多种配合物.微粒间形成配位键的条件是:一方是能够提供孤电子对的原子或离子,另一方是具有
能够接受孤电子对的空轨道
能够接受孤电子对的空轨道
的原子或离子(3)CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子:请回答下列问题:

①H、N、O三种元素的电负性由大到小的顺序是
O>N>H
O>N>H
.②SO2分子的空间构型为
V形
V形
.与SnCl4互为等电子体的一种离子的化学式为SO42-、SiO44-等
SO42-、SiO44-等

③乙二胺分子中氮原子轨道的杂化类型为
sp3杂化
sp3杂化
.乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键
乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键
.④(3)中所形成的配离子中含有的化学键类型有
abd
abd
.a.配位键 b.极性键 c.离子键 d.非极性键
⑤CuCl的晶胞结构如图所示,其中Cl原子的配位数为
4
4
.NH4Cl是强酸弱碱盐,它在水溶液里的水解过程可用如图表示:
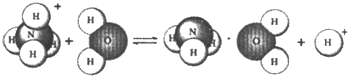
则下列有关NH4Cl溶液里存在的微粒的叙述,正确的是( )

则下列有关NH4Cl溶液里存在的微粒的叙述,正确的是( )
A、存在NH3?H2O,其结构式为: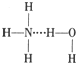 | B、存在NH4+,其空间构型为正四面体 | C、存在H3O+,其结构式为: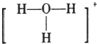 | D、不存在OH- |
下列叙述中,结论(事实)和对应的解释(事实)均不正确的是( )
| A、金刚石的熔沸点高于晶体硅,因为C-C键能大于Si-Si键能 | B、二氧化硅晶体中不存在SiO2分子,因为它含有硅氧四面体的空间网状结构 | C、稀有气体的晶体属于原子晶体,因为其组成微粒是原子,不存在分子间作用力 | D、空间构型为正四面体结构的分子中,化学键的键角不一定是109°28′,有可能为60° |
阅读以下信息,并回答问题.
数十亿年来,地球上的物质不断地变化.大气的成分也发生了很大的变化.下表是原始大气和目前空气的主要成分:
用上表所涉及的分子填写下列空白:
(1)由极性键构成的非极性分子有
(2)极易溶于水、其水溶液呈碱性的物质的分子是
(3)分子中不含孤对电子的分子(除稀有气体外)为
(4)CO的结构可表示为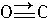 ,与CO结构最相似的分子是
,与CO结构最相似的分子是
(5)随着原始大气中O2的缓慢增加,CH4、NH3、CO等气体逐渐被氧气氧化而缓慢地减少,使大气的成分逐渐演化成目前空气.原始大气中NH3可转化为目前空气中的
(6)人工模拟是当前研究的热点.有研究表明,化合物X可用于研究模拟酶,当其结合或Cu(I)(I表示化合价为+1)时,分别形成a和b:
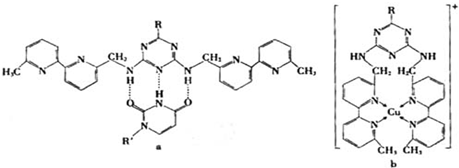
分析a和b中微粒间的相互作用(包括化学键和分子间相互作用),试指出其不同点:
a中含
查看习题详情和答案>>
数十亿年来,地球上的物质不断地变化.大气的成分也发生了很大的变化.下表是原始大气和目前空气的主要成分:
| 目前空气的主要成分 | N2、O2、CO2、水蒸气及稀有气体He、Ne等 |
| 原始大气的主要成分 | CH4、NH3、CO、CO2等 |
(1)由极性键构成的非极性分子有
CH4
CH4
和CO2
CO2
(填写化学式).(2)极易溶于水、其水溶液呈碱性的物质的分子是
NH3
NH3
(填写化学式),它之所以极易溶于水,是因为它的分子和水分子之间可形成氢
氢
键.(3)分子中不含孤对电子的分子(除稀有气体外)为
CH4
CH4
(填写化学式),它的立体构型为正四面体
正四面体
.(4)CO的结构可表示为
 ,与CO结构最相似的分子是
,与CO结构最相似的分子是N2
N2
(填写化学式),这两种结构相似的分子中,分子的极性不相同
不相同
(填“相同”或“不相同”),CO分子中有一个键的形成与另外两个不同,它叫配位
配位
键.(5)随着原始大气中O2的缓慢增加,CH4、NH3、CO等气体逐渐被氧气氧化而缓慢地减少,使大气的成分逐渐演化成目前空气.原始大气中NH3可转化为目前空气中的
N2和H2O
N2和H2O
(填化学式).(6)人工模拟是当前研究的热点.有研究表明,化合物X可用于研究模拟酶,当其结合或Cu(I)(I表示化合价为+1)时,分别形成a和b:

分析a和b中微粒间的相互作用(包括化学键和分子间相互作用),试指出其不同点:
a中含
氢键
氢键
,b中含配位键
配位键
.(用“氢键”、“配位键”、“极性键”、“非极性键”等填空)