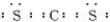题目内容
(1)第ⅢA、ⅤA元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似.Ga原子的电子排布式为
(2)铜、铁元素能形成多种配合物.微粒间形成配位键的条件是:一方是能够提供孤电子对的原子或离子,另一方是具有
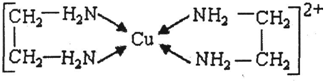
(3)CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子:请回答下列问题:
①H、N、O三种元素的电负性由大到小的顺序是
②SO2分子的空间构型为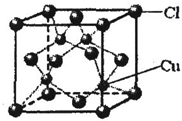
③乙二胺分子中氮原子轨道的杂化类型为
④(3)中所形成的配离子中含有的化学键类型有
a.配位键 b.极性键 c.离子键 d.非极性键
⑤CuCl的晶胞结构如图所示,其中Cl原子的配位数为
1s22s22p63s23p63d104s24p1
1s22s22p63s23p63d104s24p1
.在GaN晶体中,与同一个Ga原子相连的N原子构成的空间构型为正四面体
正四面体
.在四大晶体类型中,GaN属于原子
原子
晶体.(2)铜、铁元素能形成多种配合物.微粒间形成配位键的条件是:一方是能够提供孤电子对的原子或离子,另一方是具有
能够接受孤电子对的空轨道
能够接受孤电子对的空轨道
的原子或离子(3)CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子:请回答下列问题:

①H、N、O三种元素的电负性由大到小的顺序是
O>N>H
O>N>H
.②SO2分子的空间构型为
V形
V形
.与SnCl4互为等电子体的一种离子的化学式为SO42-、SiO44-等
SO42-、SiO44-等

③乙二胺分子中氮原子轨道的杂化类型为
sp3杂化
sp3杂化
.乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键
乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键
.④(3)中所形成的配离子中含有的化学键类型有
abd
abd
.a.配位键 b.极性键 c.离子键 d.非极性键
⑤CuCl的晶胞结构如图所示,其中Cl原子的配位数为
4
4
.分析:(1)Ga原子是31号元素,根据核外电子排布规律书写原子的电子排布式;单晶硅是Si正四面体向空间延伸的立体网状结构,为原子晶体,GaN晶体结构与单晶硅相似,GaN属于原子晶体,与同一个Ga原子相连的N原子构成的空间构型为与但晶硅中Si的结构相似;
(2)微粒间形成配位键的条件是:一方是能够提供孤电子对的原子或离子,另一方是具有能够接受孤电子对的空轨道的原子或离子;
(3)①根据电负性的变化规律比较电负性大小;
②根据判断SO2分子含有的δ键以及孤电子对数判断空间构型,根据SnCl4含有的最外层电子数为50,以及含有5个原子判断等电子体;
③根据价层电子对数判断乙二胺分子中氮原子的杂化类型,根据是否含有氢键分析二者熔沸点高低不同的原因;
④根据成键原子的特点判断化学键类型;
⑤根据晶体结构特点分析Cl原子的配位数.
(2)微粒间形成配位键的条件是:一方是能够提供孤电子对的原子或离子,另一方是具有能够接受孤电子对的空轨道的原子或离子;
(3)①根据电负性的变化规律比较电负性大小;
②根据判断SO2分子含有的δ键以及孤电子对数判断空间构型,根据SnCl4含有的最外层电子数为50,以及含有5个原子判断等电子体;
③根据价层电子对数判断乙二胺分子中氮原子的杂化类型,根据是否含有氢键分析二者熔沸点高低不同的原因;
④根据成键原子的特点判断化学键类型;
⑤根据晶体结构特点分析Cl原子的配位数.
解答:解:(1)Ga原子是31号元素,Ga原子的电子排布式为1s22s22p63s23p63d104s24p1;GaN晶体结构与单晶硅相似,GaN属于原子晶体,与同一个Ga原子相连的N原子构成的空间构型为正四面体,
故答案为:1s22s22p63s23p63d104s24p1;正四面体;原子;
(2)微粒间形成配位键的条件是:一方是能够提供孤电子对的原子或离子,另一方是具有能够接受孤电子对的空轨道的原子或离子,
故答案为:能够接受孤电子对的空轨道;
(3)①在元素周期表中同一周期从左到右元素的电负性逐渐增强,同一主族从上到下元素的电负性逐渐减弱,可知电负性强弱顺序为O>N>H,
故答案是:O>N>H;
②SO2分子中含有2个δ键,孤电子对数=
=1,所以分子为V形,SnCl4含有的价层电子数为50,并含有5个原子,与之为电子体的离子有SO42-、SiO44-等,
故答案为:V形; SO42-、SiO44-等;
③乙二胺分子中氮原子形成4个δ键,价层电子对数为4,氮原子为sp3杂化,乙二胺分子间可以形成氢键,物质的熔沸点较高,而三甲胺分子间不能形成氢键,熔沸点较低,
故答案为:sp3杂化;乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键;
④)②中所形成的配离子中含有的化学键中N与Cu之间为配位键,C-C键为非极性键,C-N、N-H、C-H键为极性键,不含离子键,
故答案为:abd;
⑤从CuCl的晶胞可以判断,每个铜原子与4个Cl距离最近且相等,即Cu的配位数为4,根据化学式可知Cl的配位数也为4,
故答案为:4.
故答案为:1s22s22p63s23p63d104s24p1;正四面体;原子;
(2)微粒间形成配位键的条件是:一方是能够提供孤电子对的原子或离子,另一方是具有能够接受孤电子对的空轨道的原子或离子,
故答案为:能够接受孤电子对的空轨道;
(3)①在元素周期表中同一周期从左到右元素的电负性逐渐增强,同一主族从上到下元素的电负性逐渐减弱,可知电负性强弱顺序为O>N>H,
故答案是:O>N>H;
②SO2分子中含有2个δ键,孤电子对数=
| 6-2×2 |
| 2 |
故答案为:V形; SO42-、SiO44-等;
③乙二胺分子中氮原子形成4个δ键,价层电子对数为4,氮原子为sp3杂化,乙二胺分子间可以形成氢键,物质的熔沸点较高,而三甲胺分子间不能形成氢键,熔沸点较低,
故答案为:sp3杂化;乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键;
④)②中所形成的配离子中含有的化学键中N与Cu之间为配位键,C-C键为非极性键,C-N、N-H、C-H键为极性键,不含离子键,
故答案为:abd;
⑤从CuCl的晶胞可以判断,每个铜原子与4个Cl距离最近且相等,即Cu的配位数为4,根据化学式可知Cl的配位数也为4,
故答案为:4.
点评:本题考查较为综合,涉及电子排布式、分子的立体构型、杂化轨道类型、氢键、化学键类型以及晶体结构分析等知识,题目具有一定难度,本题注意晶胞配位数的判断方法,可根据CuCl的化学式进行比较.

练习册系列答案
相关题目
元素周期表前7周期的元素如表所示:
|
周期数 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
元素数 |
2 |
8 |
8 |
18 |
18 |
32 |
32 |
(1)第6,7周期比第4,5周期多了14种元素,原因是 。
(2)周期表中 族所含元素最多, 族元素形成化合物最多。
(3)请分析周期数与元素数的关系,然后预言第8周期最多可能含元素种数为( )。
A.18 B.32 C.50 D.64
(4)居里夫人发现镭是元素周期表中第七周期的ⅡA族元素,下列关于镭的性质的描述中不正确的是( )。
A.在化合物中呈+2价 B.氢氧化物呈两性
C.单质使水分解,放出氧气 D.碳酸盐难溶于水