摘要:已知A和B两元素的单质气体在同温同压下能以体积比2:1完全化合成C气体.且反应后的气体体积比反应前的气体体积减小1/3.通过计算证明B元素的单质一定不是单原子分子.
网址:http://m.1010jiajiao.com/timu3_id_361546[举报]
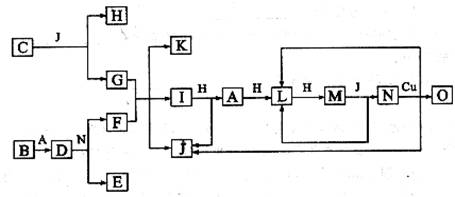
已知A至O分别代表一种物质,转化关系如图所示(反应条件略去).

已知:A、B、H分别是由短周期元素组成的单质.B与冷水难反应,与沸水可反应放出氢气.D是一种离子化合物,其阴阳离子的个数比为2:3,且D能与水反应得到两种碱.C为淡黄色固体化合物,可做防毒面具的供氧剂,O能与G的水溶液反应生成蓝色沉淀.
(1)组成B单质的元素在元素周期表位置:

(2)J的沸点比硫化氢的沸点高,其原因是
(3)写出D与足量的N反应生成E和F的化学方程式:
(4)上图中,在同一反应里一种物质既作氧化剂又作还原剂,这样的反应共有
(5)对O的水溶液100mL进行电解一段时间,若溶液pH值由5下降到1,则阴极产生物质的质量为
查看习题详情和答案>>

已知:A、B、H分别是由短周期元素组成的单质.B与冷水难反应,与沸水可反应放出氢气.D是一种离子化合物,其阴阳离子的个数比为2:3,且D能与水反应得到两种碱.C为淡黄色固体化合物,可做防毒面具的供氧剂,O能与G的水溶液反应生成蓝色沉淀.
(1)组成B单质的元素在元素周期表位置:
第三周期ⅡA族
第三周期ⅡA族
.化合物G的电子式为

(2)J的沸点比硫化氢的沸点高,其原因是
水分子之间存在氢键且比硒化氢的分子间作用力强
水分子之间存在氢键且比硒化氢的分子间作用力强
.(3)写出D与足量的N反应生成E和F的化学方程式:
Mg3N2+8HNO3═3Mg(NO3)2+2NH4NO3
Mg3N2+8HNO3═3Mg(NO3)2+2NH4NO3
.(4)上图中,在同一反应里一种物质既作氧化剂又作还原剂,这样的反应共有
2
2
个.(5)对O的水溶液100mL进行电解一段时间,若溶液pH值由5下降到1,则阴极产生物质的质量为
0.32g
0.32g
.已知A、B、C、D、E、F、G是原子序数依次增大的短周期元素,其中A原子的核内无中子;B原子的最外层电子数是内层电子数的2倍且B、C、D同周期并相邻;D与G同主族;E、F、G同周期且它们的最高价氧化物的水化物两两之间都可以相互反应生成盐和水.请回答下列问题:
(1)D的简单阴离子的结构示意图是
 ;F元素在周期表中的位置是
;F元素在周期表中的位置是
(2)D、E、F的单核离子半径由大到小的顺序为
(3)D与A按1:1原子个数比组成的化合物的电子式为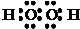
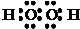 ;D与E按1:1原子个数比组成的化合物与二氧化碳反应的化学方程式为
;D与E按1:1原子个数比组成的化合物与二氧化碳反应的化学方程式为
(4)由D、F、G组成的一种常见易溶性盐可用作净水剂,其原因是
(5)工业上常用A、C元素组成的一种常见气态化合物经过三步反应来制取硝酸,则第一步反应的化学方程式为
查看习题详情和答案>>
(1)D的简单阴离子的结构示意图是


第3周期第ⅢA
第3周期第ⅢA
.(2)D、E、F的单核离子半径由大到小的顺序为
O 2->Na+>Al 3+
O 2->Na+>Al 3+
(用离子符号表示);证明B、G非金属性强弱的实验方法和现象是向Na2CO3溶液中加入稀硫酸产生大量无色无味气体
向Na2CO3溶液中加入稀硫酸产生大量无色无味气体
.(3)D与A按1:1原子个数比组成的化合物的电子式为
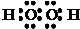
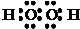
2Na2O2+2CO2=Na2CO3+O2
2Na2O2+2CO2=Na2CO3+O2
.(4)由D、F、G组成的一种常见易溶性盐可用作净水剂,其原因是
Al 3++3H2O?Al(OH)3(胶体)+3H+,生成的胶体与水中的杂质作用形成沉淀
Al 3++3H2O?Al(OH)3(胶体)+3H+,生成的胶体与水中的杂质作用形成沉淀
(用离子方程式及必要的文字说明).(5)工业上常用A、C元素组成的一种常见气态化合物经过三步反应来制取硝酸,则第一步反应的化学方程式为
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
;将G元素的一种常见气态氧化物通入C元素最高价氧化物对应的水化物中,反应的离子方程式为
| ||
| △ |
3SO2+2NO3-+2H2O=3SO42-+2NO+4H+
3SO2+2NO3-+2H2O=3SO42-+2NO+4H+
.已知A、B、C、D是四种短周期非金属元素,它们的原子序数依次增大,A元素的原子形成的阳离子就是一个质子,B原子的最外层上s电子数等于p电子数,C、D在元素周期表中处于相邻的位置,且它们的单质在常温下均为无色气体.
试回答:
(1)写出C的原子结构示意图
 ,D原子的电子排布式
,D原子的电子排布式 ,你认为
,你认为
(2)A、B两种元素组成的化合物很多,其中只含有一种类型共价键的化合物名称为
(3)这四种元素可组成多种原子个数比的化合物,其中属于离子晶体的化合物的化学式有
(4)A单质和C单质在一定条件下反应生成化合物E,E分子的空间结构为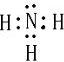
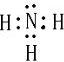 .
.
查看习题详情和答案>>
试回答:
(1)写出C的原子结构示意图


1s22s22p4
1s22s22p4
.有同学将B原子最外层电子排布的轨道表示式写成: ,你认为
,你认为正确
正确
(填“正确”或“不正确”),若不正确,请写出正确的轨道表示式此空不答
此空不答
(若正确,此空不答).(2)A、B两种元素组成的化合物很多,其中只含有一种类型共价键的化合物名称为
甲烷
甲烷
.BD2是非极性
非极性
分子(填“极性”或“非极性”).(3)这四种元素可组成多种原子个数比的化合物,其中属于离子晶体的化合物的化学式有
NH4HCO3、(NH4)2CO3、CH3COONH4
NH4HCO3、(NH4)2CO3、CH3COONH4
(任意写三种).(4)A单质和C单质在一定条件下反应生成化合物E,E分子的空间结构为
三角锥形
三角锥形
,电子式为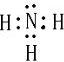
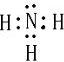
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.其中A、B、C是同一周期的非金属元素.化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构.AC2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E元素是第四周期元素中未成对电子数最多的元素,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2:1,1mol配合物与足量的AgNO3溶液反应能立即生成3molAgCl.F原子的一种核素的质量数为65,中子数为 36.请根据以上情况,回答下列问题:(答题时要用元素符号表示)
(1)B氢化物与HCl反应生成的含有B元素粒子的空间构型是 .F元素原子的最外层电子数为 个.
(2)B3-离子分别与AC2、由B、C组成的气态化合物互为等电子体,则B、C组成的化合物化学式为 ;B3-离子还可以和一价阴离子互为等电子体,这阴离子电子式为 ,这种阴离子常用于检验日常生活中的一种金属阳离子,这金属阳离子符号为
(3)A、B、C的第一电离能由小到大的顺序为
(4)E3+的核外电子排布式是 ,ECl3形成的六配位的配合物化学式为 .
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是
(6)在F的+1价氧化物的晶胞结构如右图,F为 球(“黑”“白”)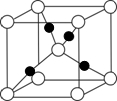
查看习题详情和答案>>
(1)B氢化物与HCl反应生成的含有B元素粒子的空间构型是
(2)B3-离子分别与AC2、由B、C组成的气态化合物互为等电子体,则B、C组成的化合物化学式为
(3)A、B、C的第一电离能由小到大的顺序为
(4)E3+的核外电子排布式是
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是
(6)在F的+1价氧化物的晶胞结构如右图,F为

(15分)已知A-O分别代表一种物质,它们之间的转化关系如下图所示(反应条件略去)。A、B、H分别是由短周期元素组成的单质。B与冷水缓慢反应,与沸水迅速反应,放出氢气。D是一种离子化合物,其阴阳离子的个数比为2:3,且能与水反就应得到两种碱。C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉淀。
![]()
![]() 请回答下列问题:
请回答下列问题:
(1) ![]() 组成B单质的元素位于周期表第______________周期,第_______________族。化合物C的电子式为__________________________________。
组成B单质的元素位于周期表第______________周期,第_______________族。化合物C的电子式为__________________________________。
(2) J的沸点比硒化氢(H2Se)的沸点高,其原因是_________________。
(3) 写出I与H在点燃条件下反应生成A和J的化学方程式:________________。
(4) 写出D与足量的N反应生成E和F的化学方程式:_____________________。
(5) 上图中,在同一反应里一种物质作氧化剂,又作还原剂,这样的反应共有_______个。
查看习题详情和答案>>