题目内容
已知A、B、C、D、E、F、G是原子序数依次增大的短周期元素,其中A原子的核内无中子;B原子的最外层电子数是内层电子数的2倍且B、C、D同周期并相邻;D与G同主族;E、F、G同周期且它们的最高价氧化物的水化物两两之间都可以相互反应生成盐和水.请回答下列问题:
(1)D的简单阴离子的结构示意图是
 ;F元素在周期表中的位置是
;F元素在周期表中的位置是
(2)D、E、F的单核离子半径由大到小的顺序为
(3)D与A按1:1原子个数比组成的化合物的电子式为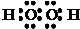
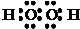 ;D与E按1:1原子个数比组成的化合物与二氧化碳反应的化学方程式为
;D与E按1:1原子个数比组成的化合物与二氧化碳反应的化学方程式为
(4)由D、F、G组成的一种常见易溶性盐可用作净水剂,其原因是
(5)工业上常用A、C元素组成的一种常见气态化合物经过三步反应来制取硝酸,则第一步反应的化学方程式为
(1)D的简单阴离子的结构示意图是


第3周期第ⅢA
第3周期第ⅢA
.(2)D、E、F的单核离子半径由大到小的顺序为
O 2->Na+>Al 3+
O 2->Na+>Al 3+
(用离子符号表示);证明B、G非金属性强弱的实验方法和现象是向Na2CO3溶液中加入稀硫酸产生大量无色无味气体
向Na2CO3溶液中加入稀硫酸产生大量无色无味气体
.(3)D与A按1:1原子个数比组成的化合物的电子式为
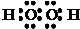
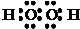
2Na2O2+2CO2=Na2CO3+O2
2Na2O2+2CO2=Na2CO3+O2
.(4)由D、F、G组成的一种常见易溶性盐可用作净水剂,其原因是
Al 3++3H2O?Al(OH)3(胶体)+3H+,生成的胶体与水中的杂质作用形成沉淀
Al 3++3H2O?Al(OH)3(胶体)+3H+,生成的胶体与水中的杂质作用形成沉淀
(用离子方程式及必要的文字说明).(5)工业上常用A、C元素组成的一种常见气态化合物经过三步反应来制取硝酸,则第一步反应的化学方程式为
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
;将G元素的一种常见气态氧化物通入C元素最高价氧化物对应的水化物中,反应的离子方程式为
| ||
| △ |
3SO2+2NO3-+2H2O=3SO42-+2NO+4H+
3SO2+2NO3-+2H2O=3SO42-+2NO+4H+
.分析:A、B、C、D、E、F、G是原子序数依次增大的短周期元素,其中A原子的核内无中子,则A是H元素;B原子的最外层电子数是内层电子数的2倍,最外层电子数不超过8个,所以内层电子数只能是2,则B是C元素,B、C、D同周期并相邻,且原子序数依次增大,所以C是N元素,D是O元素,D与G同主族则G是S元素;E、F、G同周期且它们的最高价氧化物的水化物两两之间都可以相互反应生成盐和水,G是非金属元素其最高价氧化物的水化物是酸,E的原子序数小,所以必须是金属元素且其最高价氧化物的水化物是强碱,所以F的最高价氧化物的水化物是两性物质,所以F是Al元素,E是Na元素.
(1)氧原子得到2个电子形成氧离子,画出氧离子结构示意图,根据其原子结构示意图判断在周期表中的位置,电子层数等于其周期数,最外层电子数等于其主族序数;
(2)电子层结构相同的离子其离子半径随着原子序数的增大而减小,非金属性强弱的判断方法有:其最高价含氧酸的酸性强弱、非金属之间的置换反应、氢化物的稳定性等;
(3)先确定化合物,再根据共价化合物电子式的书写规则书写,物质之间的反应写出反应方程式;
(4)铝离子能水解生成胶体,胶体具有吸附性,所以能净水;
(5)制取硝酸的第一步是用氨气和氧气反应制取一氧化氮,C元素最高价氧化物对应的水化物是硝酸具有强氧化性,G元素的一种常见气态氧化物是酸性氧化物,能和硝酸反应,所以该氧化物具有还原性,为二氧化硫,二氧化硫和硝酸发生氧化还原反应.
(1)氧原子得到2个电子形成氧离子,画出氧离子结构示意图,根据其原子结构示意图判断在周期表中的位置,电子层数等于其周期数,最外层电子数等于其主族序数;
(2)电子层结构相同的离子其离子半径随着原子序数的增大而减小,非金属性强弱的判断方法有:其最高价含氧酸的酸性强弱、非金属之间的置换反应、氢化物的稳定性等;
(3)先确定化合物,再根据共价化合物电子式的书写规则书写,物质之间的反应写出反应方程式;
(4)铝离子能水解生成胶体,胶体具有吸附性,所以能净水;
(5)制取硝酸的第一步是用氨气和氧气反应制取一氧化氮,C元素最高价氧化物对应的水化物是硝酸具有强氧化性,G元素的一种常见气态氧化物是酸性氧化物,能和硝酸反应,所以该氧化物具有还原性,为二氧化硫,二氧化硫和硝酸发生氧化还原反应.
解答:解:A、B、C、D、E、F、G是原子序数依次增大的短周期元素,其中A原子的核内无中子,则A是H元素;B原子的最外层电子数是内层电子数的2倍,最外层电子数不超过8个,所以内层电子数只能是2,则B是C元素,B、C、D同周期并相邻,且原子序数依次增大,所以C是N元素,D是O元素,D与G同主族则G是S元素;E、F、G同周期且它们的最高价氧化物的水化物两两之间都可以相互反应生成盐和水,G是非金属元素其最高价氧化物的水化物是酸,E的原子序数小,所以必须是金属元素且其最高价氧化物的水化物是强碱,所以F的最高价氧化物的水化物是两性物质,所以F是Al元素,E是Na元素.
(1)氧原子得的2个电子生成氧离子,其离子结构示意图为: ,铝的原子结构示意图为
,铝的原子结构示意图为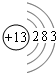 ,所以铝元素处于第3周期第ⅢA;
,所以铝元素处于第3周期第ⅢA;
故答案为: ,第3周期第ⅢA;
,第3周期第ⅢA;
(2)电子层结构相同的离子其离子半径随着原子序数的增大而减小,所以D、E、F的单核离子半径由大到小的顺序为O 2->Na+>Al 3+,向Na2CO3溶液中加入稀硫酸产生大量无色无味气体,根据强酸制取弱酸知碳酸的酸性小于硫酸的,所以碳元素的非金属性小于硫元素;
故答案为:O 2->Na+>Al 3+,向Na2CO3溶液中加入稀硫酸产生大量无色无味气体;
(3)D与A按1:1原子个数比组成的化合物是双氧水,双氧水的电子式为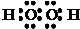 ,D与E按1:1原子个数比组成的化合物是过氧化钠,过氧化钠和二氧化碳反应生成碳酸钠和氧气,反应方程式为2Na2O2+2CO2=Na2CO3+O2;
,D与E按1:1原子个数比组成的化合物是过氧化钠,过氧化钠和二氧化碳反应生成碳酸钠和氧气,反应方程式为2Na2O2+2CO2=Na2CO3+O2;
故答案为: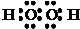 ,2Na2O2+2CO2=Na2CO3+O2;
,2Na2O2+2CO2=Na2CO3+O2;
(4)由D、F、G组成的一种常见易溶性盐是硫酸铝,铝离子易水解生成氢氧化铝胶体Al 3++3H2O?Al(OH)3(胶体)+3H+,胶体具有吸附性,能吸附悬浮物,所以能净水;
故答案为:Al 3++3H2O?Al(OH)3(胶体)+3H+,生成的胶体与水中的杂质作用形成沉淀;
(5)A、C元素组成的一种常见气态化合物是氨气,氨气和氧气在催化剂加热条件下反应生成一氧化氮和水,反应方程式为4NH3+5O2
4NO+6H2O,C元素最高价氧化物对应的水化物是硝酸具有强氧化性,G元素的一种常见气态氧化物是酸性氧化物,能和硝酸反应,所以该氧化物具有还原性,为二氧化硫,二氧化硫和硝酸反应生成硫酸和一氧化氮,离子方程式为:3SO2+2NO3-+2H2O=3SO42-+2NO+4H+;
故答案为:4NH3+5O2
4NO+6H2O,3SO2+2NO3-+2H2O=3SO42-+2NO+4H+.
(1)氧原子得的2个电子生成氧离子,其离子结构示意图为:
 ,铝的原子结构示意图为
,铝的原子结构示意图为 ,所以铝元素处于第3周期第ⅢA;
,所以铝元素处于第3周期第ⅢA;故答案为:
 ,第3周期第ⅢA;
,第3周期第ⅢA;(2)电子层结构相同的离子其离子半径随着原子序数的增大而减小,所以D、E、F的单核离子半径由大到小的顺序为O 2->Na+>Al 3+,向Na2CO3溶液中加入稀硫酸产生大量无色无味气体,根据强酸制取弱酸知碳酸的酸性小于硫酸的,所以碳元素的非金属性小于硫元素;
故答案为:O 2->Na+>Al 3+,向Na2CO3溶液中加入稀硫酸产生大量无色无味气体;
(3)D与A按1:1原子个数比组成的化合物是双氧水,双氧水的电子式为
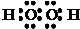 ,D与E按1:1原子个数比组成的化合物是过氧化钠,过氧化钠和二氧化碳反应生成碳酸钠和氧气,反应方程式为2Na2O2+2CO2=Na2CO3+O2;
,D与E按1:1原子个数比组成的化合物是过氧化钠,过氧化钠和二氧化碳反应生成碳酸钠和氧气,反应方程式为2Na2O2+2CO2=Na2CO3+O2;故答案为:
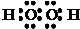 ,2Na2O2+2CO2=Na2CO3+O2;
,2Na2O2+2CO2=Na2CO3+O2;(4)由D、F、G组成的一种常见易溶性盐是硫酸铝,铝离子易水解生成氢氧化铝胶体Al 3++3H2O?Al(OH)3(胶体)+3H+,胶体具有吸附性,能吸附悬浮物,所以能净水;
故答案为:Al 3++3H2O?Al(OH)3(胶体)+3H+,生成的胶体与水中的杂质作用形成沉淀;
(5)A、C元素组成的一种常见气态化合物是氨气,氨气和氧气在催化剂加热条件下反应生成一氧化氮和水,反应方程式为4NH3+5O2
| ||
| △ |
故答案为:4NH3+5O2
| ||
| △ |
点评:本题以元素化合物的推断为载体考查了元素化合物的性质的综合性题,能正确推断元素是解本题的关键,根据电子式的书写、氧化还原反应、水解、元素周期律等知识来分析解答即可,难度不大.

练习册系列答案
 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
已知A、B、C、D分别是Cu、Ag、Fe、Al四种金属中的一种.已知①A、C均能与稀硫酸反应放出气体;②B与D的硝酸盐反应,置换出单质D;③C与强碱反应放出气体,由此可以推断A、B、C、D依次是( )
| A、Fe、Cu、Al、Ag | B、Al、Cu、Fe、Ag | C、Cu、Ag、Al、Fe | D、Ag、Al、Cu、Fe |

 已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素.
已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素. (Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答:
(Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答: