网址:http://m.1010jiajiao.com/timu3_id_361333[举报]
阅读下面的文言文,完成下面5题。
李斯论 (清)姚鼐
苏子瞻谓李斯以荀卿之学乱天下,是不然。秦之乱天下之法,无待于李斯,斯亦未尝以其学事秦。
|
君子之仕也,进不隐贤;小人之仕也,无论所学识非也,即有学识甚当,见其君国行事,悖谬无义,疾首嚬蹙于私家之居,而矜夸导誉于朝庭之上,知其不义而劝为之者,谓天下将谅我之无可奈何于吾君,而不吾罪也;知其将丧国家而为之者,谓当吾身容可以免也。且夫小人虽明知世之将乱,而终不以易目前之富贵,而以富贵之谋,贻天下之乱,固有终身安享荣乐,祸遗后人,而彼宴然①无与者矣。嗟乎!秦未亡而斯先被五刑夷三族也,其天之诛恶人,亦有时而信也邪!
且夫人有为善而受教于人者矣,未闻为恶而必受教于人者也。荀卿述先王而颂言儒效,虽间有得失,而大体得治世之要。而苏氏以李斯之害天下罪及于卿,不亦远乎?行其学而害秦者,商鞅也;舍其学而害秦者,李斯也。商君禁游宦,而李斯谏逐客②,其始之不同术也,而卒出于同者,岂其本志哉!宋之世,王介甫以平生所学,建熙宁新法,其后章惇、曾布、张商英、蔡京之伦,曷尝学介甫之学耶?而以介甫之政促亡宋,与李斯事颇相类。夫世言法术之学足亡人国,固也。吾谓人臣善探其君之隐,一以委曲变化从世好者,其为人尤可畏哉!尤可畏哉!
[注释]①宴然:安闲的样子。②谏逐客:秦始皇曾发布逐客令,驱逐六国来到秦国做官的人,李斯写了著名的《谏逐客书》,提出了反对意见。
对下列句子中加点的词语的解释,不正确的一项是( )
A.非是不足以中侈君张吾之宠 中:符合
B.灭三代法而尚督责 尚:崇尚
C.知其不义而劝为之者 劝:鼓励
D.而终不以易目前之富贵 易:交换
下列各组句子中,加点的词的意义和用法相同的一组是( )
A.因秦国地形便利 不如因普遇之
B.设所遭值非始皇、二世 非其身之所种则不食
C.且夫小人虽明知世之将乱 臣死且不避,卮酒安足辞
D.不亦远乎 王之好乐甚,则齐国其庶几乎
下列各项中,加点词语与现代汉语意义不相同的一项是( )
A.小人之仕也,无论所学识非也
B.而大体得治世之要
C.而以富贵之谋,贻天下之乱
D.一以委曲变化从世好者
下列各句中对文章的阐述,不正确的一项是( )
A.苏轼认为李斯以荀卿之学辅佐秦朝行暴政,致使天下大乱,作者则认为李斯是完全舍弃了荀子的说学,李斯的做法只不过是追随时势罢了。
B.作者由论李斯事秦进而泛论人臣事君的问题,强调为臣者对于国君的“悖谬无义”之政,不应为自身的富贵而阿附甚至助长之。
C.此文主旨在于指出秦行暴政是君王自身的原因,作者所论的不可“趋时”,“中侈君张吾之宠”的道理,在今天仍有借鉴意义。
D.文章开门见山,摆出苏轼的观点,然后通过对秦国发展历史的分析,驳斥了苏说的谬论,提出了自己的见解。论证严密,逐层深入,是一篇典范的史论。
把文言文阅读材料中画横线的句子翻译成现代汉语。
(1)秦之甘于刻薄而便于严法久矣
译文:
(2)谓天下将谅我之无可奈何于吾君,而不吾罪也
译文:
(3)其始之不同术也,而卒出于同者,岂其本志哉
译文:
查看习题详情和答案>>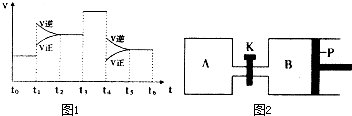
(1)一定条件下,充入2mol SO2(g)和2mol O2(g),20s后,测得SO2的体积百分含量为12.5%,则用SO2表示该反应在这20s内的反应速率为
(2)下面的叙述可作为判断(1)中可逆反应达到平衡状态依据的是(填序号)
①v正(SO2)=2v正(O2) ②混合气体的密度不变
③混合气体的平均相对分子质量不变 ④各气体的浓度都不再发生变化
(3)图1表示该反应的速率(v)随时间(t)的变化的关系.则下列不同时间段中,SO3的百分含量最高的是
A、t0→t1 B、t2→t3 C、t3→t4 D、t5→t6
据图分析:你认为t3时改变的外界条件可能是
(4)图2中P是可自由平行滑动的活塞.在相同温度时,向A容器中充入4mol SO3(g),关闭K,向B容器中充入2mol SO3(g),两容器分别发生反应.已知起始时容器A和B的体积均为aL.试回答:
①反应达到平衡时容器B的体积为1.2a L,容器B中SO3转化率为
②若打开K,一段时间后重新达到平衡,容器B的体积为
(5)已知单质硫的燃烧热为△H=-296kJ/mol,经测定由S(s)生成120gSO3(g)可放热592.5kJ,请写出SO2(g)氧化生成SO3(g)的热化学方程式
| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数 (Ka) |
7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 |
3.0×10-8 |
(2)将浓度为0.1mol/LHF溶液加水稀释一倍(假设温度不变),下列各量增大的是
A.c(H+) B.c(H+)?c(OH-) C.
| c(H+) |
| c(HF) |
| c(OH-) |
| c(H+) |
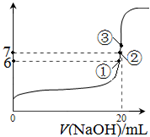
(3)25℃时,在20mL0.1mol/L氢氟酸中加入VmL0.1mol/LNaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是
A.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中,c(F-)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20mL,此时溶液中c(F-)<c(Na+)=0.1mol/L
(4)物质的量浓度均为0.1mol/L的下列四种溶液:①Na2CO3溶液②NaHCO3溶液③NaF溶液④NaClO溶液.
依据数据判断pH由大到小的顺序是
(5)Na2CO3溶液显碱性是因为CO32-水解的缘故,请设计简单的实验事实证明之
(6)长期以来,一直认为氟的含氧酸不存在.1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H-O-F.HFO与水反应得到HF和化合物A,每生成1molHF转移
电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
|
化学式 |
HF |
H2CO3 |
HClO |
|
电离平衡常数 (Ka) |
7.2×10-4 |
K1=4.4×10-7 K2=4.7×10-11 |
3.0×10-8 |
(1)已知25℃时,①HF(aq)+OH—(aq)=F—(aq)+H2O(l) ΔH=-67.7kJ/mol,
②H+(aq)+OH—(aq)=H2O(l) ΔH=-57.3kJ/mol ,
氢氟酸的电离方程式及热效应可表示为________________________。
(2)将浓度为0.1 mol/LHF溶液加水稀释一倍(假设温度不变),下列各量增大的是____。
A.c(H+) B.c(H+)·c(OH—) C. D.
D.
(3)25℃时,在20mL0.1mol/L氢氟酸中加入VmL0.1mol/LNaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是_____。

A.pH=3的HF溶液和pH=11的NaF溶液中, 由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中,c(F—)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(F—)=c(Na+)
D.③点时V=20mL,此时溶液中c(F—)< c(Na+)=0.1mol/L
(4)物质的量浓度均为0.1mol/L的下列四种溶液: ① Na2CO3溶液 ② NaHCO3溶液 ③ NaF溶液 ④NaClO溶液。依据数据判断pH由大到小的顺序是______________。
(5)Na2CO3溶液显碱性是因为CO32—水解的缘故,请设计简单的实验事实证明之
___________________________________________________________。
(6)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H—O—F。HFO与水反应得到HF和化合物A,每生成1molHF转移 mol电子。
查看习题详情和答案>>
已知体积为2L的恒容密闭容器中发生反应: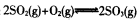 ,请根据化学反应的有关原理同答下列问题
,请根据化学反应的有关原理同答下列问题
(1)一定条件下,充入2 mol SO2(g)和2 mol O2(g),20 s后,测得SO2的体积百分含量为12.5%,则用SO2表示该反应在这20s内的反应速率为____,此时,该密闭容器内混合气体的压强是反应前的____倍。
(2)下面的叙述可作为判断(1)中可逆反应达到平衡状态依据的是(填序号)____。
①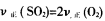
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④各气体的浓度都不再发生变化
(3)下图表示该反应的速率(v)随时间(t)的变化的关系。则下列不同时间段中,SO3的百分含量最高的是( )
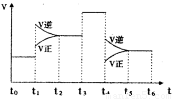

据图分析:你认为t3时改变的外界条件可能是 ;
t6时保持体积不变向体系中充人少量SO3,再次平衡后
SO2的体积百分含量比t6时 (填“大”\“小”或“等于”)。
(4)下图中P是可自由平行滑动的活塞。在相同温度时,向A容器中充入4 mol SO3(g),关闭K,向B容器中充入2 mol SO3(g),两容器分别发生反应。
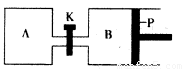
已知起始时容器A和B的体积均为aL。试回答:
①反应达到平衡时容器B的体积为1.2a L,容器B中SO3转
化率为____
②若打开K,一段时间后重新达到平衡,容器B的体积为 __L(连通管中气体体积忽略不计,且不考虑温度的影响)。
(5)已知单质硫的燃烧热为△H=-296kJ/mol,经测定由S(s)生成120gSO3(g)可放热592.5kJ,请写出SO2(g)氧化生成SO3(g)的热化学方程式____。
查看习题详情和答案>>