题目内容
| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数 (Ka) |
7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 |
3.0×10-8 |
(2)将浓度为0.1mol/LHF溶液加水稀释一倍(假设温度不变),下列各量增大的是
A.c(H+) B.c(H+)?c(OH-) C.
| c(H+) |
| c(HF) |
| c(OH-) |
| c(H+) |
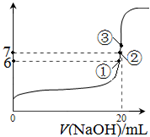
(3)25℃时,在20mL0.1mol/L氢氟酸中加入VmL0.1mol/LNaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是
A.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中,c(F-)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20mL,此时溶液中c(F-)<c(Na+)=0.1mol/L
(4)物质的量浓度均为0.1mol/L的下列四种溶液:①Na2CO3溶液②NaHCO3溶液③NaF溶液④NaClO溶液.
依据数据判断pH由大到小的顺序是
(5)Na2CO3溶液显碱性是因为CO32-水解的缘故,请设计简单的实验事实证明之
(6)长期以来,一直认为氟的含氧酸不存在.1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H-O-F.HFO与水反应得到HF和化合物A,每生成1molHF转移
(2)氢氟酸是弱电解质,溶液中存在电离平衡,加水稀释其溶液促进氢氟酸电离,注意水的离子积常数只与温度有关;
(3)A.酸或碱抑制水电离,含有弱根离子的盐促进水电离;
B.根据电荷守恒计算;
C.根据电荷守恒计算;
D.等物质的量的氢氟酸和氢氧化钠恰好反应生成氟化钠,溶液呈碱性,根据电荷守恒判断,注意等体积混合时,不水解离子浓度变为原来的一半;
(4)等物质的量浓度的钠盐溶液,酸根离子水解程度越大其溶液的pH越大;
(5)设计实验使溶液中的CO32-由有到无,再根据酚酞的颜色变化起作用的是否是碳酸根离子;
(6)根据原子守恒确定A,再根据化合价变化计算转移电子.
故答案为:HF(aq)?H+(aq)+F-(aq)△H=-10.4KJ?mol-1;
(2)氢氟酸是弱电解质,溶液中存在电离平衡,加水稀释其溶液促进氢氟酸电离,
A.稀释过程中促进氢氟酸电离,但c(H+)减小,故错误;
B.温度不变,水的离子积常数不变,所以c(H+)?c(OH-)不变,故错误;
C.稀释过程中促进氢氟酸电离,氢离子个数增大,氟化氢分子个数减小,所以
| c(H+) |
| c(HF) |
D.稀释过程中促进氢氟酸电离,氢离子浓度降低,氢氧根离子浓度增大,所以
| c(OH-) |
| c(H+) |
故选CD;
(3)A.氢氟酸抑制水电离,氟化钠促进水电离,所以pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的不相等,故错误;
B.①点时pH=6,溶液中存在电荷守恒,c(F-)+c(OH-)=c(Na+)+c(H+),所以c(F-)-c(Na+)=c(H+)-c(OH-)=9.9×10-7mol/L,故正确;
C.②点时,溶液呈中性,c(OH-)=c(H+),溶液中存在电荷守恒,c(F-)+c(OH-)=c(Na+)+c(H+),
所以c(F-)=c(Na+),故正确;
D.③点时V=20mL,此时溶液中溶质在氟化钠,溶液呈碱性,根据电荷守恒知c(F-)<c(Na+),但等体积混合时不水解的离子浓度变为原来的一半,所以c(F-)<c(Na+)=0.05mol/L,故错误;
故选BC;
(4)等物质的量浓度的钠盐溶液,酸根离子水解程度越大其溶液的pH越大,酸的电离常数越小其酸根离子水解程度越大,所以等物质的量浓度的①Na2CO3溶液②NaHCO3溶液③NaF溶液④NaClO溶液中pH由大到小的顺序是:
①④②③,故答案为:①④②③;
(5)为证明纯碱溶液呈碱性是由CO32-引起的,就设计一个使溶液中的碳酸根离子由有到无的实验,根据溶液中酚酞颜色的变化判断,所以设计的实验为:在碳酸钠溶液中滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去或变浅,则说明Na2CO3溶液显碱性是因为CO32-水解的缘故,
故答案为:在碳酸钠溶液中滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去或变浅;
(6)根据原子守恒知,该反应方程式为:HFO+H2O=HF+H2O2,根据元素化合价知,每生成1molHF转移 1mol电子,故答案为:1.

电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
|
化学式 |
HF |
H2CO3 |
HClO |
|
电离平衡常数 (Ka) |
7.2×10-4 |
K1=4.4×10-7 K2=4.7×10-11 |
3.0×10-8 |
(1)已知25℃时,①HF(aq)+OH—(aq)=F—(aq)+H2O(l) ΔH=-67.7kJ/mol,
②H+(aq)+OH—(aq)=H2O(l) ΔH=-57.3kJ/mol ,
氢氟酸的电离方程式及热效应可表示为________________________。
(2)将浓度为0.1 mol/LHF溶液加水稀释一倍(假设温度不变),下列各量增大的是____。
A.c(H+) B.c(H+)·c(OH—) C. D.
D.
(3)25℃时,在20mL0.1mol/L氢氟酸中加入VmL0.1mol/LNaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是_____。

A.pH=3的HF溶液和pH=11的NaF溶液中, 由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中,c(F—)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(F—)=c(Na+)
D.③点时V=20mL,此时溶液中c(F—)< c(Na+)=0.1mol/L
(4)物质的量浓度均为0.1mol/L的下列四种溶液: ① Na2CO3溶液 ② NaHCO3溶液 ③ NaF溶液 ④NaClO溶液。依据数据判断pH由大到小的顺序是______________。
(5)Na2CO3溶液显碱性是因为CO32—水解的缘故,请设计简单的实验事实证明之
___________________________________________________________。
(6)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H—O—F。HFO与水反应得到HF和化合物A,每生成1molHF转移 mol电子。
 已知25℃时部分弱电解质的电离平衡常数数据如下表:
已知25℃时部分弱电解质的电离平衡常数数据如下表:
 NF3+3NH4F
NF3+3NH4F
 )具有弱酸性,其Ka=1.1 ×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1 ×10-10;水杨酸第一级电离形成的离子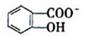 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”),其原因是__________。
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”),其原因是__________。 Mg2++2OH-,NH4++OH-
Mg2++2OH-,NH4++OH-