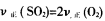题目内容
已知体积为2L的恒容密闭容器中发生反应:2SO2(g)+O2(g)?2SO3(g),请根据化学反应的有关原理同答下列问题
(1)一定条件下,充入2mol SO2(g)和2mol O2(g),20s后,测得SO2的体积百分含量为12.5%,则用SO2表示该反应在这20s内的反应速率为 ,此时,该密闭容器内混合气体的压强是反应前的 倍.
(2)下面的叙述可作为判断(1)中可逆反应达到平衡状态依据的是(填序号) .
①v正(SO2)=2v正(O2) ②混合气体的密度不变
③混合气体的平均相对分子质量不变 ④各气体的浓度都不再发生变化
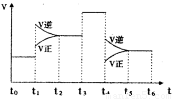
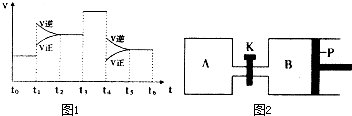
(3)图1表示该反应的速率(v)随时间(t)的变化的关系.则下列不同时间段中,SO3的百分含量最高的是
A、t0→t1 B、t2→t3 C、t3→t4 D、t5→t6
据图分析:你认为t3时改变的外界条件可能是 ;t6时保持体积不变向体系中充入少量SO3,再次平衡后SO2的体积百分含量比t6时 (填“大”、“小”或“等于”).
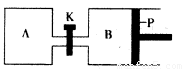
(4)图2中P是可自由平行滑动的活塞.在相同温度时,向A容器中充入4mol SO3(g),关闭K,向B容器中充入2mol SO3(g),两容器分别发生反应.已知起始时容器A和B的体积均为aL.试回答:
①反应达到平衡时容器B的体积为1.2a L,容器B中SO3转化率为
②若打开K,一段时间后重新达到平衡,容器B的体积为 L(连通管中气体体积忽略不计,且不考虑温度的影响).
(5)已知单质硫的燃烧热为△H=-296kJ/mol,经测定由S(s)生成120gSO3(g)可放热592.5kJ,请写出SO2(g)氧化生成SO3(g)的热化学方程式 .

(1)一定条件下,充入2mol SO2(g)和2mol O2(g),20s后,测得SO2的体积百分含量为12.5%,则用SO2表示该反应在这20s内的反应速率为
(2)下面的叙述可作为判断(1)中可逆反应达到平衡状态依据的是(填序号)
①v正(SO2)=2v正(O2) ②混合气体的密度不变
③混合气体的平均相对分子质量不变 ④各气体的浓度都不再发生变化
(3)图1表示该反应的速率(v)随时间(t)的变化的关系.则下列不同时间段中,SO3的百分含量最高的是
A、t0→t1 B、t2→t3 C、t3→t4 D、t5→t6
据图分析:你认为t3时改变的外界条件可能是
(4)图2中P是可自由平行滑动的活塞.在相同温度时,向A容器中充入4mol SO3(g),关闭K,向B容器中充入2mol SO3(g),两容器分别发生反应.已知起始时容器A和B的体积均为aL.试回答:
①反应达到平衡时容器B的体积为1.2a L,容器B中SO3转化率为
②若打开K,一段时间后重新达到平衡,容器B的体积为
(5)已知单质硫的燃烧热为△H=-296kJ/mol,经测定由S(s)生成120gSO3(g)可放热592.5kJ,请写出SO2(g)氧化生成SO3(g)的热化学方程式
分析:(1)设出二氧化硫的转化率,根据SO2的体积百分含量计算出转化率,再计算出达到平衡时各组分的浓度,根据反应速率的表达式计算出用SO2表示该反应在这20s内的反应速率;根据气体的物质的量之比等于压强之比计算出反应前后压强关系;
(2)可逆反应达到平衡状态时,正逆反应速率相等,各组分的浓度、百分含量不再变化,据此进行判断;
(3)根据图1各时间段中,改变反应条件后化学平衡的移动方向判断三氧化硫的物质的量变化;根据正逆反应速率变化判断改变的条件;根据加入三氧化硫达到的平衡,与原平衡相比,相当于增大了压强分析;
(4)根据恒温恒压条件下,气体的物质的量之比等于容器的容积之比计算出消耗的三氧化硫的物质的量;根据等效平衡的知识判断6mol三氧化硫达到平衡时容器的体积,然后计算出打开K后容器B的体积;
(5)根据题中的反应热写出反应的热化学方程式,然后利用盖斯定律写出SO2(g)氧化生成SO3(g)的热化学方程式.
(2)可逆反应达到平衡状态时,正逆反应速率相等,各组分的浓度、百分含量不再变化,据此进行判断;
(3)根据图1各时间段中,改变反应条件后化学平衡的移动方向判断三氧化硫的物质的量变化;根据正逆反应速率变化判断改变的条件;根据加入三氧化硫达到的平衡,与原平衡相比,相当于增大了压强分析;
(4)根据恒温恒压条件下,气体的物质的量之比等于容器的容积之比计算出消耗的三氧化硫的物质的量;根据等效平衡的知识判断6mol三氧化硫达到平衡时容器的体积,然后计算出打开K后容器B的体积;
(5)根据题中的反应热写出反应的热化学方程式,然后利用盖斯定律写出SO2(g)氧化生成SO3(g)的热化学方程式.
解答:解:(1)设二氧化硫的转化率为x,则
2SO2(g)+O2(g)?2SO3(g)
开始(mol):2 2 0
开始(mol):2x x 2x
平衡(mol):2-2x 2-x 2x
20s后,测得SO2的体积百分含量为12.5%,相同条件下,气体的 体积分数等于物质的量分数,即:
×100%=12.5%,解得x=0.8,
反应消耗的二氧化硫的物质的量为:2mol×0.8mol=1.6mol,用SO2表示该反应在这20s内的反应速率为:v(SO2)=
=0.04mol/(L?s);
达到平衡时混合气体的物质的量为:(2-1.6)mol+(2-0.8)mol+1.6mol=3.2mol,气体的体积之比等于物质的量之比,该密闭容器内混合气体的压强与反应前压强之比为:
=0.8,
故答案为:0.04mol/(L?s);0.8;
(2)①v正(SO2)=2v正(O2)在这个反应中是不管是否达到平衡状态一直存在,无法判断是否达到平衡状态,故①错误;
②混合气体的密度也是时刻不变的,因为反应前后都是气体,质量守恒,而且体积是固定的,故②错误;
③该反应前后质量一定,但是正向是气体物质的量减小的方向,因此这是达到平衡的一个重要标志,故③正确;
④各气体的浓度不再变化时,说明正逆反应速率相等,达到了平衡状态,故④正确;
故选③④;
(3)A、t0→t1 时反应达到了初始平衡状态;
B、t2→t3,在t1时正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向着逆向移动,说明是升高了温度,三氧化硫的含量减小,小于t0→t1;
C、t3→t4,正逆反应速率都增大且相等,说明使用了催化剂,化学平衡不移动,三氧化硫的含量不变,与t2→t3相等;
D、t5→t6,正逆反应速率都减小,正反应速率减小的更多,平衡向着逆向移动,说明是减小了压强,三氧化硫的含量减小,小于t3→t4,
所以三氧化硫的含量最高的为t0→t1;
t3时正逆反应速率都增大,且相等,说明使用了催化剂;
t6时保持体积不变向体系中充入少量SO3,相当于知道了压强,达到平衡时二氧化硫转化率增大,二氧化硫的百分含量减小,所以再次平衡后SO2的体积百分含量比t6时减小,
故答案为:A;加入催化剂;减小;
(4)①反应达到平衡时容器B的体积为1.2a L,B为恒压条件下,容器的容积与气体的物质的量成正比,说明达到平衡时气体的物质的量为反应前的1.2倍,即平衡时混合气体的物质的量为2.4mol,气体物质的量之间了0.2mol,设反应消耗了三氧化硫nmol,则
2SO3(g)?2SO2(g)+O2(g)△n
2 2 1 1mol
n 0.4mol
n=0.8mol,三氧化硫的转化率为:
×100%=40%,
故答案为:40%;
②若打开K,一段时间后重新达到平衡,在恒温恒压条件下,与向B中进入6mol三氧化硫达到的平衡为等效平衡,所以达到平衡时整个容器的容积为:
×1.2a=3.6a,所以容器B的体积为:3.6a-a=2.6a,
故答案为:2.6a;
(5)根据硫的燃烧热可以写成热化学方程式:①S(s)+O2(g)=SO2(g)△H=-296 KJ?mol-1,
120g三氧化硫的物质的量为1.5mol,由S(s)生成120gSO3(g)可放热592.5kJ,生成3mol三氧化硫可以放出1185 kJ热量,
反应的出热化学方程式为:②3S(s)+
O2(g)=3SO3(g)△H=-1185 KJ?mol-1,
则利用盖斯定律将②÷3-①可得:SO2(g)+
O2(g)=SO3(g)△H=-99 KJ?mol-1,
故答案为:SO2(g)+
O2(g)=SO3(g)△H=-99 KJ?mol-1.
2SO2(g)+O2(g)?2SO3(g)
开始(mol):2 2 0
开始(mol):2x x 2x
平衡(mol):2-2x 2-x 2x
20s后,测得SO2的体积百分含量为12.5%,相同条件下,气体的 体积分数等于物质的量分数,即:
| 2-2x |
| 2-2x+(2-x)+2x |
反应消耗的二氧化硫的物质的量为:2mol×0.8mol=1.6mol,用SO2表示该反应在这20s内的反应速率为:v(SO2)=
| ||
| 20s |
达到平衡时混合气体的物质的量为:(2-1.6)mol+(2-0.8)mol+1.6mol=3.2mol,气体的体积之比等于物质的量之比,该密闭容器内混合气体的压强与反应前压强之比为:
| 3.2mol |
| 4mol |
故答案为:0.04mol/(L?s);0.8;
(2)①v正(SO2)=2v正(O2)在这个反应中是不管是否达到平衡状态一直存在,无法判断是否达到平衡状态,故①错误;
②混合气体的密度也是时刻不变的,因为反应前后都是气体,质量守恒,而且体积是固定的,故②错误;
③该反应前后质量一定,但是正向是气体物质的量减小的方向,因此这是达到平衡的一个重要标志,故③正确;
④各气体的浓度不再变化时,说明正逆反应速率相等,达到了平衡状态,故④正确;
故选③④;
(3)A、t0→t1 时反应达到了初始平衡状态;
B、t2→t3,在t1时正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向着逆向移动,说明是升高了温度,三氧化硫的含量减小,小于t0→t1;
C、t3→t4,正逆反应速率都增大且相等,说明使用了催化剂,化学平衡不移动,三氧化硫的含量不变,与t2→t3相等;
D、t5→t6,正逆反应速率都减小,正反应速率减小的更多,平衡向着逆向移动,说明是减小了压强,三氧化硫的含量减小,小于t3→t4,
所以三氧化硫的含量最高的为t0→t1;
t3时正逆反应速率都增大,且相等,说明使用了催化剂;
t6时保持体积不变向体系中充入少量SO3,相当于知道了压强,达到平衡时二氧化硫转化率增大,二氧化硫的百分含量减小,所以再次平衡后SO2的体积百分含量比t6时减小,
故答案为:A;加入催化剂;减小;
(4)①反应达到平衡时容器B的体积为1.2a L,B为恒压条件下,容器的容积与气体的物质的量成正比,说明达到平衡时气体的物质的量为反应前的1.2倍,即平衡时混合气体的物质的量为2.4mol,气体物质的量之间了0.2mol,设反应消耗了三氧化硫nmol,则
2SO3(g)?2SO2(g)+O2(g)△n
2 2 1 1mol
n 0.4mol
n=0.8mol,三氧化硫的转化率为:
| 0.8mol |
| 2mol |
故答案为:40%;
②若打开K,一段时间后重新达到平衡,在恒温恒压条件下,与向B中进入6mol三氧化硫达到的平衡为等效平衡,所以达到平衡时整个容器的容积为:
| 6mol |
| 2mol |
故答案为:2.6a;
(5)根据硫的燃烧热可以写成热化学方程式:①S(s)+O2(g)=SO2(g)△H=-296 KJ?mol-1,
120g三氧化硫的物质的量为1.5mol,由S(s)生成120gSO3(g)可放热592.5kJ,生成3mol三氧化硫可以放出1185 kJ热量,
反应的出热化学方程式为:②3S(s)+
| 9 |
| 2 |
则利用盖斯定律将②÷3-①可得:SO2(g)+
| 1 |
| 2 |
故答案为:SO2(g)+
| 1 |
| 2 |
点评:本题考查了化学反应速率与化学平衡图象的综合应用、化学平衡的计算、热化学方程式的书写、化学平衡状态的判断等知识,题目难度较大,试题内容较多,充分考查了学生对所学知识的掌握情况.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目

 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
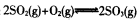 ,请根据化学反应的有关原理同答下列问题
,请根据化学反应的有关原理同答下列问题