摘要:将含NaCl杂质的NaOH样品5g.配成1200mL溶液.测得溶液的pH值为13.此样品的纯度为:A.80%,B.84%,C.94%,D.96%.
网址:http://m.1010jiajiao.com/timu3_id_361320[举报]
(2010?徐汇区二模)卤水中的主要成分为食盐(假设其所含杂质仅为NaBr),为了充分利用资源,有研究人员开发了以晒盐卤水和化肥碳酸氢铵为原料制取纯碱的工艺,其生产流程如图.

(1)写出卤水和碳酸氢铵反应的化学方程式
(2)操作I是
(3)若滤渣中含有NH4Cl杂质,则可能导致纯碱中混有杂质,写出煅烧时产生杂质的副反应的化学方程式
(4)实验室检测滤渣中是否含有NH4Cl的操作是
(5)碳酸氢铵与氯化钠的配料比是影响纯碱质量的因素之一,如图是
(摩尔比)对NaHCO3产率的影响.实际生产中选择
=1.2.
①下列相关说法正确的是
a.碳酸氢铵过量是为了充分利用卤水
b.碳酸氢铵过量是为了减少纯碱中的NaCl
c.碳酸氢铵过量太多将会导致生产成本过高
②不考虑生产过程中的损耗,生产1mol纯碱,需消耗碳酸氢铵
查看习题详情和答案>>

(1)写出卤水和碳酸氢铵反应的化学方程式
NaCl+NH4HCO3=NaHCO3↓+NH4Cl
NaCl+NH4HCO3=NaHCO3↓+NH4Cl
;(2)操作I是
过滤、洗涤
过滤、洗涤
(填操作名称),试剂X为盐酸
盐酸
,残液除NH4Cl外,还含有NaBr
NaBr
;(3)若滤渣中含有NH4Cl杂质,则可能导致纯碱中混有杂质,写出煅烧时产生杂质的副反应的化学方程式
NaHCO3+NH4Cl
NaCl+NH3↑+H2O+CO2↑
| ||
NaHCO3+NH4Cl
NaCl+NH3↑+H2O+CO2↑
;
| ||
(4)实验室检测滤渣中是否含有NH4Cl的操作是
取洗涤液,加入足量硝酸至溶液呈酸性,再滴加硝酸银溶液,无沉淀说明纯净
取洗涤液,加入足量硝酸至溶液呈酸性,再滴加硝酸银溶液,无沉淀说明纯净
;
(5)碳酸氢铵与氯化钠的配料比是影响纯碱质量的因素之一,如图是
| n(NH4HCO3) |
| n(NaCl) |
| n(NH4HCO3) |
| n(NaCl) |
①下列相关说法正确的是
bc
bc
.a.碳酸氢铵过量是为了充分利用卤水
b.碳酸氢铵过量是为了减少纯碱中的NaCl
c.碳酸氢铵过量太多将会导致生产成本过高
②不考虑生产过程中的损耗,生产1mol纯碱,需消耗碳酸氢铵
2.4
2.4
mol.(2013?漳州二模)工业生产纯碱的过程如下:粗盐水
滤液
滤渣
纯碱
完成下列填空:
(1)粗盐水(含杂质离子Mg2+、Ca2+),加入沉淀剂A、B除杂质(A来源于石灰窑厂),则沉淀剂B的化学式为
(2)实验室模拟由滤液制备滤渣的装置如下:

①图1中装置和图2中装置的连接方法为a接
②图2中试剂瓶内发生的化学反应方程式为
③实验中要求通入的NH3过量之后再通入CO2气体,检验通入的NH3已过量的实验操作是
(3)操作=5\*MERGEFORMAT ⑤煅烧后的纯碱中含有未分解的碳酸氢钠.某同学称取该纯碱样品m g,再充分加热至质量不再变化时称得剩余固体的质量为n g,则纯碱样品中碳酸钠的质量分数为
×100%
×100%.
(4)现有25℃下,0.1mol/LNH3?H2O溶液和0.1mol/LNH4Cl溶液,将两份溶液等体积混合测得溶液的pH=9,下列说法正确的是
A.0.1mol/L NH4Cl溶液与混合后溶液中导电粒子的种类和数目均相同
b.混合后的溶液中,c(NH3?H2O)>c(Cl-)>c(NH4+)>c(OH-)>c(H+)
c.由题意可知,NH3?H2O的电离程度大于同浓度的NH4Cl的水解程度
d.混合前两份溶液的pH之和大于14.
查看习题详情和答案>>
| ①先后加入沉淀剂A、B |
| ②过滤 |
| ③先后通入NH3CO2 |
| ④过滤 |
| ⑤煅烧 |
完成下列填空:
(1)粗盐水(含杂质离子Mg2+、Ca2+),加入沉淀剂A、B除杂质(A来源于石灰窑厂),则沉淀剂B的化学式为
Na2CO3
Na2CO3
.(2)实验室模拟由滤液制备滤渣的装置如下:

①图1中装置和图2中装置的连接方法为a接
d
d
,b接e
e
,f接c.②图2中试剂瓶内发生的化学反应方程式为
NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
.③实验中要求通入的NH3过量之后再通入CO2气体,检验通入的NH3已过量的实验操作是
用蘸有浓盐酸的玻璃棒靠近管口f,若有白烟生成,说明氨气过量;或用湿润的红色石蕊试纸靠进管口f,若试纸变蓝,说明氨气过量
用蘸有浓盐酸的玻璃棒靠近管口f,若有白烟生成,说明氨气过量;或用湿润的红色石蕊试纸靠进管口f,若试纸变蓝,说明氨气过量
.(3)操作=5\*MERGEFORMAT ⑤煅烧后的纯碱中含有未分解的碳酸氢钠.某同学称取该纯碱样品m g,再充分加热至质量不再变化时称得剩余固体的质量为n g,则纯碱样品中碳酸钠的质量分数为
| 84n-53m |
| 31m |
| 84n-53m |
| 31m |
(4)现有25℃下,0.1mol/LNH3?H2O溶液和0.1mol/LNH4Cl溶液,将两份溶液等体积混合测得溶液的pH=9,下列说法正确的是
cd
cd
(填代号).A.0.1mol/L NH4Cl溶液与混合后溶液中导电粒子的种类和数目均相同
b.混合后的溶液中,c(NH3?H2O)>c(Cl-)>c(NH4+)>c(OH-)>c(H+)
c.由题意可知,NH3?H2O的电离程度大于同浓度的NH4Cl的水解程度
d.混合前两份溶液的pH之和大于14.
纯碱中常含少量的NaCl等杂质,利用图仪器装置可用来测定纯碱中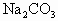 的质量百分含量(即质量分数).
的质量百分含量(即质量分数).
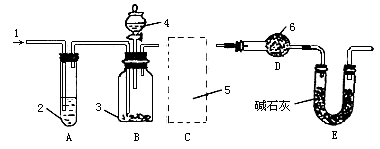
图中:1.空气,2.某溶液,3.纯碱,4.稀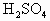 ,E.碱石灰.
,E.碱石灰.
其实验步骤是:
A.按上图所示,组装好实验仪器,并检查其气密性;
B.准确称量盛有碱石灰的干燥管D的质量(设为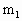 g);
g);
C.准确称量一定量的纯碱(设为n g),并将其放进广口瓶内;
D.从分液漏斗中缓缓滴入一定量稀硫酸,并从“1”处缓缓鼓入空气,至B反应器中不再产生气体为止;
E.准确称量干燥管D的总质量(设为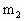 g).
g).
根据上述实验,回答下列问题:
(1)该实验进行至操作d时,要缓缓鼓入空气,鼓入空气的作用是________.装置A中盛装的液体“2”应选用_______,装置A的作用是_______;如果撤去装置A,直接向装置B中缓缓鼓入空气,则会导致实验测定结果_______(填偏大、偏小或不变).
(2)在空白格内画出装置C及试剂;装置C盛放的试剂“5”是_______;说明装置C的作用是_______;如果撤去装置C,则会导致实验测定结果_______(填偏大、偏小或不变).
(3)根据此实验,计算纯碱中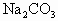 的质量;百分含量(即质量分数)的数学式为_______.(用
的质量;百分含量(即质量分数)的数学式为_______.(用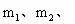 n表示)
n表示)
(4)装置E的作用是_______.
查看习题详情和答案>>