题目内容
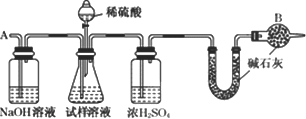
纯碱中常含少量的NaCl等杂质,利用图仪器装置可用来测定纯碱中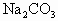 的质量百分含量(即质量分数).
的质量百分含量(即质量分数).
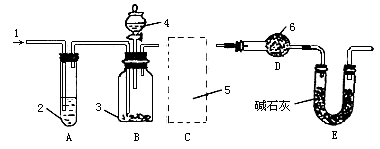
图中:1.空气,2.某溶液,3.纯碱,4.稀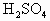 ,E.碱石灰.
,E.碱石灰.
其实验步骤是:
A.按上图所示,组装好实验仪器,并检查其气密性;
B.准确称量盛有碱石灰的干燥管D的质量(设为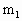 g);
g);
C.准确称量一定量的纯碱(设为n g),并将其放进广口瓶内;
D.从分液漏斗中缓缓滴入一定量稀硫酸,并从“1”处缓缓鼓入空气,至B反应器中不再产生气体为止;
E.准确称量干燥管D的总质量(设为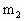 g).
g).
根据上述实验,回答下列问题:
(1)该实验进行至操作d时,要缓缓鼓入空气,鼓入空气的作用是________.装置A中盛装的液体“2”应选用_______,装置A的作用是_______;如果撤去装置A,直接向装置B中缓缓鼓入空气,则会导致实验测定结果_______(填偏大、偏小或不变).
(2)在空白格内画出装置C及试剂;装置C盛放的试剂“5”是_______;说明装置C的作用是_______;如果撤去装置C,则会导致实验测定结果_______(填偏大、偏小或不变).
(3)根据此实验,计算纯碱中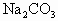 的质量;百分含量(即质量分数)的数学式为_______.(用
的质量;百分含量(即质量分数)的数学式为_______.(用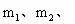 n表示)
n表示)
(4)装置E的作用是_______.
答案:
解析:
解析:
|
(1)把反应器B中产生的 (2) (3) (4)防止空气中水蒸气、二氧化碳进入干燥管D中 |

练习册系列答案
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案
相关题目
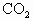 气送入干燥管D中,NaOH溶液,除去空气中的
气送入干燥管D中,NaOH溶液,除去空气中的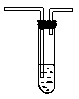 浓硫酸,干燥
浓硫酸,干燥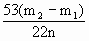 ×100%;
×100%;

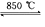 NaCl(l)+ K(g)。工业上应采用哪些措施才能使反应向正反应方向移动?___________________
NaCl(l)+ K(g)。工业上应采用哪些措施才能使反应向正反应方向移动?___________________