摘要: 一种以地下茎繁殖为主的多年生野菊分别生长在海拔10m.500m和1000m的同一山坡上.在相应生长发育阶段.同一海拔的野菊株高无显著差异.但不同海拔的野菊株高随海拔的增高而显著变矮.为检验环境和遗传因素对野菊株高的影响.请完成以下实验设计. (1)实验处理:春天.将海拔500m和1000m处的野菊幼芽同时移栽于10m处. (2)实验对照:生长于 m处的野菊. (3)收集数据:第二年秋天 . (4)预测支持下列假设的实验结果: 假设一 野菊株高的变化只受环境因素的影响.实验结果是:移栽至10m处的野菊株高 . 假设二 野菊株高的变化只受遗传因素的影响.实验结果是:移栽至10m处的野菊株高 . 假设三 野菊株高的变化受遗传和环境因素的共同影响.实验结果是:移栽至10m处的野菊株高 .
网址:http://m.1010jiajiao.com/timu3_id_36109[举报]
过渡排放CO2会造成“温室效应”,科学家正在研究如何将CO2转化为可利用的资源.其中一种方案就是将CO2转化为可再生燃料甲醇(CH3OH).其化学方程式为:
请填空:
(1)写出上述反应的平衡常数表达式
(2)在容积为2L的密闭容器中,用一定量的二氧化碳和一定量氢气在一定条件下合成甲醇,实验结果如图所示.下列说法正确的是
 A.在300℃,从反应开始到平衡,甲醇的平均反应速率v(CH3OH)=
A.在300℃,从反应开始到平衡,甲醇的平均反应速率v(CH3OH)=
mol?(L?min)-1
B.反应体系从300℃升温到500℃,平衡常数K变化大
C.该反应的正反应为放热反应
D.处于C点的反应体系从300℃升高到500℃,
增大
(3)25℃,1.01×105Pa时,16g 液态甲醇完全燃烧,当恢复到原状态时,放出369.2kJ的热量,该反应的热化学方程式为:
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极应加入或通入的物质是
查看习题详情和答案>>

请填空:
(1)写出上述反应的平衡常数表达式
K=
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
K=
:| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
(2)在容积为2L的密闭容器中,用一定量的二氧化碳和一定量氢气在一定条件下合成甲醇,实验结果如图所示.下列说法正确的是
CD
CD
(填序号) A.在300℃,从反应开始到平衡,甲醇的平均反应速率v(CH3OH)=
A.在300℃,从反应开始到平衡,甲醇的平均反应速率v(CH3OH)=| nA |
| tA |
B.反应体系从300℃升温到500℃,平衡常数K变化大
C.该反应的正反应为放热反应
D.处于C点的反应体系从300℃升高到500℃,
| n(H2) |
| n(CH3OH) |
(3)25℃,1.01×105Pa时,16g 液态甲醇完全燃烧,当恢复到原状态时,放出369.2kJ的热量,该反应的热化学方程式为:
CH3OH(l)+
O2=CO2(g)+2H2O(l)△H=-725.8kJ/mol
| 3 |
| 2 |
CH3OH(l)+
O2=CO2(g)+2H2O(l)△H=-725.8kJ/mol
.| 3 |
| 2 |
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极应加入或通入的物质是
甲醇
甲醇
;正极的电极反应式:O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
.2011年11月28日至12月9日,联合国气候变化框架公约第17次缔约方会议在南非德班召开,随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.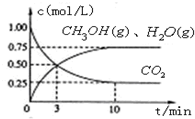
(1)目前工业上有一种方法是用CO2来生产燃料甲醇.为探究该反应原理,进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3.25mol H2,在一定条件下发生反应,测定CO2、CH3OH(g)和H2O (g)的浓度随时间变化如图所示:
①写出该工业方法制取甲醇的化学反应方程式 .
②从反应开始到平衡,氢气的平均反应速率v (H2)= mol/(Lmin).
③该条件下CO2的转化率为 .当温度降低时CO2的转化率变大,则该反应△H 0(填“>”“<”或“=”).
④下列措施中能使n(CH3OH)/n(CO2)增大的是 .
A.升高温度 B.充入氮气
C.将水蒸气从体系中分离 D.用更有效的催化剂
(2)选用合适的合金作为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此燃料电池负极的电极方程式为 .
查看习题详情和答案>>

(1)目前工业上有一种方法是用CO2来生产燃料甲醇.为探究该反应原理,进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3.25mol H2,在一定条件下发生反应,测定CO2、CH3OH(g)和H2O (g)的浓度随时间变化如图所示:
①写出该工业方法制取甲醇的化学反应方程式
②从反应开始到平衡,氢气的平均反应速率v (H2)=
③该条件下CO2的转化率为
④下列措施中能使n(CH3OH)/n(CO2)增大的是
A.升高温度 B.充入氮气
C.将水蒸气从体系中分离 D.用更有效的催化剂
(2)选用合适的合金作为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此燃料电池负极的电极方程式为
工厂烟道气中SO2直接排放到空气中会形成酸雨污染环境.利用海水脱硫是一种有效的方法,其工艺流程见图1:
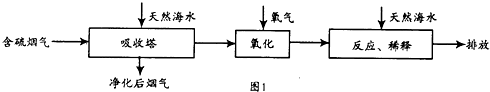
(1)常温下,无污染天然海水pH约为8,呈 性.
(2)天然海水吸收了含硫烟气后,要用O2进行氧化处理,其反应的化学方程式为 .
(3)为研究脱硫率与温度、含硫烟气SO2浓度的关系,实验结果如下:
则T= .由表中实验数据可得出的结论是 .
(4)为测定某工厂烟道气中SO2的含量,使16.00L烟道气缓慢通过1.00L水,设SO2完全被吸收,且溶液体积不变.取出20.00mL溶液,加入2~3滴淀粉溶液后,用1.18×10-3mol?L-1的饱和碘水(密度为1g?cm-3)滴定,消耗19.07mL时溶液出现蓝色,则该厂烟道气中SO2的含量为 mg?L-1.
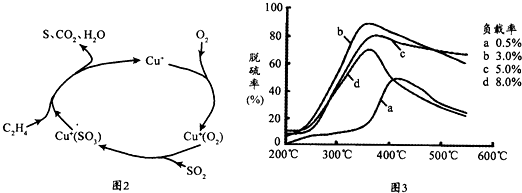
(5)目前,科学家正在研究一种以乙烯作为还原剂的脱硫(SO2)方法,其脱硫机理如图2,脱硫率与温度、负载率(分子筛中催化剂的质量分数)的关系如图3.
①该脱硫源理总反应的化学方程式为 .
②为达到最佳脱硫效果,应采取的反应条件是 .
 查看习题详情和答案>>
查看习题详情和答案>>

(1)常温下,无污染天然海水pH约为8,呈
(2)天然海水吸收了含硫烟气后,要用O2进行氧化处理,其反应的化学方程式为
(3)为研究脱硫率与温度、含硫烟气SO2浓度的关系,实验结果如下:
| 实验序号 | 温度(K) | 含硫烟气SO2浓度(10-6mol.l-1) | 脱硫率(%) |
| Ⅰ | 298 | 400 | 99.5 |
| Ⅱ | T | 500 | 97.1 |
| Ⅲ | 313 | 400 | 94.3 |
(4)为测定某工厂烟道气中SO2的含量,使16.00L烟道气缓慢通过1.00L水,设SO2完全被吸收,且溶液体积不变.取出20.00mL溶液,加入2~3滴淀粉溶液后,用1.18×10-3mol?L-1的饱和碘水(密度为1g?cm-3)滴定,消耗19.07mL时溶液出现蓝色,则该厂烟道气中SO2的含量为
(5)目前,科学家正在研究一种以乙烯作为还原剂的脱硫(SO2)方法,其脱硫机理如图2,脱硫率与温度、负载率(分子筛中催化剂的质量分数)的关系如图3.
①该脱硫源理总反应的化学方程式为
②为达到最佳脱硫效果,应采取的反应条件是
 查看习题详情和答案>>
查看习题详情和答案>>
随着化石能源的减少,新能源的开发利用日益迫切.
(1)Bunsen热化学循环制氢工艺由下列三个反应组成:
SO2(g)+I2(g)+2H2O(g)=2HI (g)+H2SO4(l)△H=a kJ?mol-1
2H2SO4(l)=2H2O(g)+2SO2(g)+O2(g)△H=b kJ?mol-1
2HI(g)=H2(g)+I2(g)△H=c kJ?mol-1
则:2H2O(g)=2H2(g)+O2(g)△H= kJ?mol-1
(2)甲醇制氢有以下三个反应:
CH3OH(g)=CO(g)+2H2(g)△H=+90.8kJ?mol-1 Ⅰ
CO(g)+H2O(g)=CO2(g)+H2(g)△H=-43.5kJ?mol-1 Ⅱ
CH3OH(g)+
O2(g)=CO2(g)+2H2(g)△H=-192.0kJ?mol-1 Ⅲ
①当CH3OH(g)、O2(g)、H2O(g)总进料量为1mol时,且n(CH3OH):n(H2O):n(O2)=0.57:0.28:0.15,在0.1MPa、473~673K温度范围内,各组分的平衡组成随温度变化的关系曲线见图.(图中Yi表示各气体的体积分数,氧气的平衡浓度接近0,图中未标出).下列说法正确的是 .
A.在0.1MPa、473~673K温度范围内,甲醇有很高的转化率
B.温度升高有利于氢气的制备
C.寻找在较低温度下的催化剂在本制氢工艺中至关重要
②已知反应Ⅱ在T1℃时K=1,向恒容的密闭容器中同时充入1.0mol CO、3.0molH2O,达到平衡时CO的转化率为 .在反应达到平衡后再向其中加入1.0mol CO、1.0mol H2O、1.0mol CO2和1.0mol H2,此时该反应的v正 v逆(填“>”、“<”或“=”).
(3)一种以甲醇作燃料的电池示意图见图.写出该电池放电时负极的电极反应式: .
(4)LiBH4有很高的燃烧热,可做火箭的燃料,写出其燃烧反应的化学方程式: .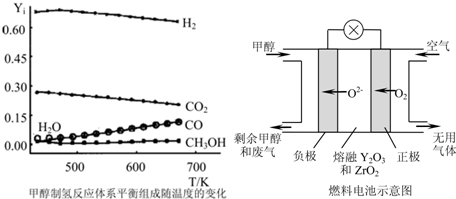
查看习题详情和答案>>
(1)Bunsen热化学循环制氢工艺由下列三个反应组成:
SO2(g)+I2(g)+2H2O(g)=2HI (g)+H2SO4(l)△H=a kJ?mol-1
2H2SO4(l)=2H2O(g)+2SO2(g)+O2(g)△H=b kJ?mol-1
2HI(g)=H2(g)+I2(g)△H=c kJ?mol-1
则:2H2O(g)=2H2(g)+O2(g)△H=
(2)甲醇制氢有以下三个反应:
CH3OH(g)=CO(g)+2H2(g)△H=+90.8kJ?mol-1 Ⅰ
CO(g)+H2O(g)=CO2(g)+H2(g)△H=-43.5kJ?mol-1 Ⅱ
CH3OH(g)+
| 1 | 2 |
①当CH3OH(g)、O2(g)、H2O(g)总进料量为1mol时,且n(CH3OH):n(H2O):n(O2)=0.57:0.28:0.15,在0.1MPa、473~673K温度范围内,各组分的平衡组成随温度变化的关系曲线见图.(图中Yi表示各气体的体积分数,氧气的平衡浓度接近0,图中未标出).下列说法正确的是
A.在0.1MPa、473~673K温度范围内,甲醇有很高的转化率
B.温度升高有利于氢气的制备
C.寻找在较低温度下的催化剂在本制氢工艺中至关重要
②已知反应Ⅱ在T1℃时K=1,向恒容的密闭容器中同时充入1.0mol CO、3.0molH2O,达到平衡时CO的转化率为
(3)一种以甲醇作燃料的电池示意图见图.写出该电池放电时负极的电极反应式:
(4)LiBH4有很高的燃烧热,可做火箭的燃料,写出其燃烧反应的化学方程式:

(2010?泰州三模)烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点.
(1)烟气脱硫、脱硝的环境意义是
(2)选择性催化还原法的脱硝原理为:6NOx+4x NH3
(3+2x)N2+6xH2O
①上述反应中每转移3mol电子,生成标准状况下N2的体积为
L.
②已知:2H2(g)+O2(g)=2H2O (g)△H=-483.6kJ?mol-1
N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ?mol-1
N2(g)+O2(g)=2NO(g)△H=-180.5kJ?mol-1
则反应6NO(g)+4NH3(g)=5N2(g)+6H2O(g)的△H=
(3)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如下图1,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2所示.
①写出该脱硝原理总反应的化学方程式:
②为达到最佳脱硝效果,应采取的条件是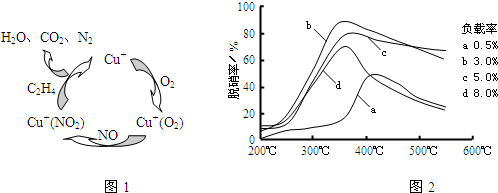
查看习题详情和答案>>
(1)烟气脱硫、脱硝的环境意义是
防止酸雨的发生
防止酸雨的发生
.(2)选择性催化还原法的脱硝原理为:6NOx+4x NH3
| ||
①上述反应中每转移3mol电子,生成标准状况下N2的体积为
| 16.8+11.2x |
| x |
| 16.8+11.2x |
| x |
②已知:2H2(g)+O2(g)=2H2O (g)△H=-483.6kJ?mol-1
N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ?mol-1
N2(g)+O2(g)=2NO(g)△H=-180.5kJ?mol-1
则反应6NO(g)+4NH3(g)=5N2(g)+6H2O(g)的△H=
-724.5kJ?mol-1
-724.5kJ?mol-1
.(3)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如下图1,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2所示.
①写出该脱硝原理总反应的化学方程式:
6NO+3O2+2C2H4
3N2+4CO2+4H2O
| ||
6NO+3O2+2C2H4
3N2+4CO2+4H2O
.
| ||
②为达到最佳脱硝效果,应采取的条件是
350℃、负载率3%
350℃、负载率3%
.