题目内容
工厂烟道气中SO2直接排放到空气中会形成酸雨污染环境.利用海水脱硫是一种有效的方法,其工艺流程见图1: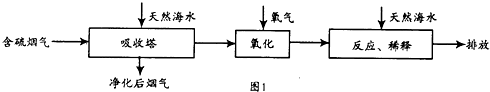
(1)常温下,无污染天然海水pH约为8,呈
(2)天然海水吸收了含硫烟气后,要用O2进行氧化处理,其反应的化学方程式为
(3)为研究脱硫率与温度、含硫烟气SO2浓度的关系,实验结果如下:
| 实验序号 | 温度(K) | 含硫烟气SO2浓度(10-6mol.l-1) | 脱硫率(%) |
| Ⅰ | 298 | 400 | 99.5 |
| Ⅱ | T | 500 | 97.1 |
| Ⅲ | 313 | 400 | 94.3 |
(4)为测定某工厂烟道气中SO2的含量,使16.00L烟道气缓慢通过1.00L水,设SO2完全被吸收,且溶液体积不变.取出20.00mL溶液,加入2~3滴淀粉溶液后,用1.18×10-3mol?L-1的饱和碘水(密度为1g?cm-3)滴定,消耗19.07mL时溶液出现蓝色,则该厂烟道气中SO2的含量为
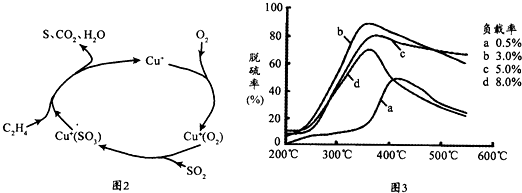
(5)目前,科学家正在研究一种以乙烯作为还原剂的脱硫(SO2)方法,其脱硫机理如图2,脱硫率与温度、负载率(分子筛中催化剂的质量分数)的关系如图3.
①该脱硫源理总反应的化学方程式为
②为达到最佳脱硫效果,应采取的反应条件是
分析:(1)pH约为8,应呈碱性;
(2)天然海水吸收了含硫烟气后,含有亚硫酸,具有还原性,可被氧气氧化生成硫酸;
(3)脱硫率与温度、含硫烟气SO2浓度的关系,应在相同温度比较不同浓度的影响,以及相同浓度不同温度的影响;
(4)反应的方程式为SO2+I2+2H2O=H2SO4+2HI,根据方程式计算;
(5)由图2可知以乙烯作为还原剂的脱硫最终生成S、二氧化碳和水;由图2可知,最佳脱硫效果应是b曲线且温度不能太高.
(2)天然海水吸收了含硫烟气后,含有亚硫酸,具有还原性,可被氧气氧化生成硫酸;
(3)脱硫率与温度、含硫烟气SO2浓度的关系,应在相同温度比较不同浓度的影响,以及相同浓度不同温度的影响;
(4)反应的方程式为SO2+I2+2H2O=H2SO4+2HI,根据方程式计算;
(5)由图2可知以乙烯作为还原剂的脱硫最终生成S、二氧化碳和水;由图2可知,最佳脱硫效果应是b曲线且温度不能太高.
解答:解:(1)pH约为8,应呈碱性或弱碱性,故答案为:碱或弱碱;
(2)天然海水吸收了含硫烟气后,要用O2进行氧化处理,氧气将H2SO3氧化为硫酸,该反应为2H2SO3+O2═2H2SO4,故答案为:2H2SO3+O2═2H2SO4;
(3)脱硫率与温度、含硫烟气SO2浓度的关系,应在相同温度比较不同浓度的影响,以及相同浓度不同温度的影响,则T应为298K,由表中数据可知得出的结论是在其它条件不变,温度为298K时比313K脱硫效率高,含硫烟气浓度400时比500时脱硫效率高或温度越低、含硫烟气浓度较低时有利于脱硫效率,
故答案为:298;在其它条件不变,温度为298K时比313K脱硫效率高,含硫烟气浓度400时比500时脱硫效率高或温度越低、含硫烟气浓度较低时有利于脱硫效率;
(4)n(I2)=1.18×10-3mol?L-1×19.07×10-3L=22.50×10-6mol,
由方程式SO2+I2+2H2O=H2SO4+2HI可知,n(SO2)=22.50×10-6mol,
则16.00L烟道气中含有的n(SO2)=22.50×10-6mol×
=1.125×10-3mol,
质量为1.125×10-3mol×64g/mol=7.2×10-2g=72mg,
所以则该厂烟道气中SO2的含量为
=4.5mg/L,
故答案为:4.5;
(5)①由图2可知以乙烯作为还原剂的脱硫最终生成S、二氧化碳和水,反应的方程式为2SO2+3O2+2C2H4
2S+2CO2+2H2O,
故答案为:2SO2+3O2+2C2H4
2S+2CO2+2H2O;
②由图2可知,最佳脱硫效果应是b曲线且温度不能太高,应选择350℃最合适,故答案为:350℃,负载率3.0%.
(2)天然海水吸收了含硫烟气后,要用O2进行氧化处理,氧气将H2SO3氧化为硫酸,该反应为2H2SO3+O2═2H2SO4,故答案为:2H2SO3+O2═2H2SO4;
(3)脱硫率与温度、含硫烟气SO2浓度的关系,应在相同温度比较不同浓度的影响,以及相同浓度不同温度的影响,则T应为298K,由表中数据可知得出的结论是在其它条件不变,温度为298K时比313K脱硫效率高,含硫烟气浓度400时比500时脱硫效率高或温度越低、含硫烟气浓度较低时有利于脱硫效率,
故答案为:298;在其它条件不变,温度为298K时比313K脱硫效率高,含硫烟气浓度400时比500时脱硫效率高或温度越低、含硫烟气浓度较低时有利于脱硫效率;
(4)n(I2)=1.18×10-3mol?L-1×19.07×10-3L=22.50×10-6mol,
由方程式SO2+I2+2H2O=H2SO4+2HI可知,n(SO2)=22.50×10-6mol,
则16.00L烟道气中含有的n(SO2)=22.50×10-6mol×
| 1000 |
| 20 |
质量为1.125×10-3mol×64g/mol=7.2×10-2g=72mg,
所以则该厂烟道气中SO2的含量为
| 72mg |
| 16L |
故答案为:4.5;
(5)①由图2可知以乙烯作为还原剂的脱硫最终生成S、二氧化碳和水,反应的方程式为2SO2+3O2+2C2H4
| ||
故答案为:2SO2+3O2+2C2H4
| ||
②由图2可知,最佳脱硫效果应是b曲线且温度不能太高,应选择350℃最合适,故答案为:350℃,负载率3.0%.
点评:本题以二氧化硫的污染为载体综合考查化学方程式的计算,侧重于学生的分析能力和计算能力的考查,为高频考点,足以把握题给信息,答题时注意审题,难度中等.

练习册系列答案
相关题目