摘要:将Na2SO4•10H2O.Na2CO3•10H2O.NaCl.Na2O各10g分别投入100g水的四只烧杯中.所得溶液质量分数最小的是( ) A. Na2SO4•10H2O B. Na2CO3•10H2O C. NaCl D. Na2O
网址:http://m.1010jiajiao.com/timu3_id_360965[举报]
某温度下,若将Na2SO4溶液蒸发掉180 g水,可恰好变成饱和溶液。若向该溶液中加入14. 2 g无水Na2SO4
也可恰好变成饱和溶液。若在该溶液中加入Na2SO4·10H2O形成饱和溶液时所需Na2SO4·10H2O的质量为
也可恰好变成饱和溶液。若在该溶液中加入Na2SO4·10H2O形成饱和溶液时所需Na2SO4·10H2O的质量为
[ ]
A.14.2 g
B.32.2 g
C.35.8 g
D.64.4 g
查看习题详情和答案>>
B.32.2 g
C.35.8 g
D.64.4 g
|
某温度下,若将Na2SO4溶液蒸发180 g水,可变成饱和溶液.若向该溶液中加入14.2 g无水Na2SO4也可变成饱和溶液.若在该溶液中加入Na2SO4·10H2O形成饱和溶液时所需Na2SO4·10H2O的质量可以为 | |
A. |
14.2 g |
B. |
32.2 g |
C. |
35.8 g |
D. |
46.4 g |
硫及其化合物有广泛的应用,对SO2性质的研究是高中化学教学的一项重要内容.
(1)对比研究是一种重要的研究方法.若将硫的单质及部分化合物按如下表所示分成3组,则第2组中物质M的化学式是 .
(2)某校化学学习小组用下图所示的实验装置研究SO2的性质.
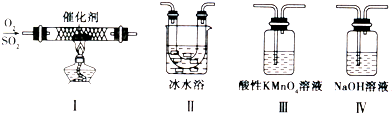
①在装置Ⅰ中发生SO2的催化氧化反应,其化学方程式是 .
②若按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,(已知:SO3熔点 16.8℃; SO2 沸点-10℃.)装置Ⅱ的作用是 ;装置Ⅲ中溶液逐渐褪色,生成Mn2+的同时pH降低,则该反应的离子方程式是 .
③若按Ⅰ、Ⅱ、Ⅳ的顺序连接装置,如果装置Ⅳ中有30mL 2.5mol/LNaOH溶液,反应后增重4.8g,则装置Ⅳ中发生反应的化学方程式是 .
查看习题详情和答案>>
(1)对比研究是一种重要的研究方法.若将硫的单质及部分化合物按如下表所示分成3组,则第2组中物质M的化学式是
| 第1组 | 第2组 | 第3组 |
| S(单质) | SO2、H2SO3、M、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |

①在装置Ⅰ中发生SO2的催化氧化反应,其化学方程式是
②若按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,(已知:SO3熔点 16.8℃; SO2 沸点-10℃.)装置Ⅱ的作用是
③若按Ⅰ、Ⅱ、Ⅳ的顺序连接装置,如果装置Ⅳ中有30mL 2.5mol/LNaOH溶液,反应后增重4.8g,则装置Ⅳ中发生反应的化学方程式是
用如图装置可以进行测定SO2转化成SO3的转化率的实验.已知SO3的熔点是16.8℃,沸点是44.8℃.已知发生装置中所涉及反应的化学方程式为:Na2SO3(s)+H2SO4(85%)═Na2SO4+SO2↑+H2O
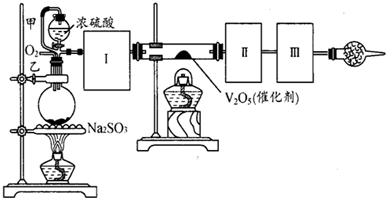
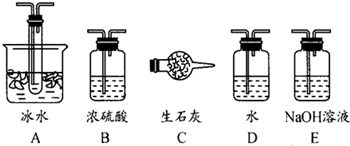
(1)根据实验需要,应该在Ⅰ、Ⅱ、Ⅲ处连接合适的装置.请从图A~E装置中选择最适合装置并将其序号填入下面的空格中.Ⅰ、Ⅱ、Ⅲ处连接的装置分别是
(2)从乙处均匀通入O2,为使SO2有较高的转化率,实验中在加热催化剂与滴加浓硫酸的顺序中,首先应采取的操作是
(3)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象不明显,但又不存在气密性问题,请你推测可能的原因并说明相应的验证方法(可以不填满).
①原因
②原因
③原因
(4)将SO2通入含1.5mol氯酸的溶液中,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式
(5)用amolNa2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,测得装置Ⅲ增重了bg,则实验中SO2的转化率为
%(用含a、b的代数式填写)
查看习题详情和答案>>

(1)根据实验需要,应该在Ⅰ、Ⅱ、Ⅲ处连接合适的装置.请从图A~E装置中选择最适合装置并将其序号填入下面的空格中.Ⅰ、Ⅱ、Ⅲ处连接的装置分别是
B
B
、A
A
、E
E
.
(2)从乙处均匀通入O2,为使SO2有较高的转化率,实验中在加热催化剂与滴加浓硫酸的顺序中,首先应采取的操作是
先加热催化剂再滴入浓硫酸
先加热催化剂再滴入浓硫酸
.(3)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象不明显,但又不存在气密性问题,请你推测可能的原因并说明相应的验证方法(可以不填满).
①原因
Na2SO3变质
Na2SO3变质
,验证方法取待测试样于试管中,加适量蒸馏水配成溶液,先滴入足量稀盐酸,再滴入BaCl2溶液有白色沉淀生成,则证明该Na2SO3固体变质
取待测试样于试管中,加适量蒸馏水配成溶液,先滴入足量稀盐酸,再滴入BaCl2溶液有白色沉淀生成,则证明该Na2SO3固体变质
;②原因
不是浓硫酸
不是浓硫酸
,验证方法用洁净玻璃棒蘸取待测试样,涂白纸不变黑,则证明该溶液不是浓硫酸
用洁净玻璃棒蘸取待测试样,涂白纸不变黑,则证明该溶液不是浓硫酸
;③原因
无
无
,验证方法无
无
.(4)将SO2通入含1.5mol氯酸的溶液中,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式
SO2+2HClO3=H2SO4+2ClO2
SO2+2HClO3=H2SO4+2ClO2
.(5)用amolNa2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,测得装置Ⅲ增重了bg,则实验中SO2的转化率为
| 1600a-25b |
| 16a |
| 1600a-25b |
| 16a |
 能源的开发利用与人类社会的可持续性发展息息相关.
能源的开发利用与人类社会的可持续性发展息息相关.I已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)△H1=akJ?mol-1
CO(g)+
| 1 |
| 2 |
4Fe(s)+3O2(g)=2Fe2O3(s)△H3=ckJ?mol-1
则C的燃烧热
II(I)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是
A.C(s)+C02(g)=2C0(g)
B.Na0H(aq)+HCl(aq)=NaCl(aq)+H20(1)
C.2H20(l)=2H2(g)+02(g)
D.2C0(g)+02(g)=2C02(g)
若以熔融的K2CO3与CO2为反应的环境,依据所选反应设计成一个原电池,诸写出该原电池的负极反应:
(2)某实验小组模拟工业合成氨反应N2+3H2
| 高温、高压 |
| 催化剂 |
| P |
| P0 |
①反应达平衡的标志是(填字母代号)
A.压强保持不变
B.气体密度保持不变
C.NH3的生成速率是N2的生成速率的2倍
②2min时,以C(N2)变化表示的平均反应速率为
③若提高N2的转化率可采取的措施有
A.向体系中按体积比1:1再充入N2和H2 B.分离出NH3
C.升高温度 D.充入He气使压强增大 E.加入一定量的N2
(3)25°C时,BaCO3和BaSO4的溶度积常数分别是8×10-9和1×10-10,某含有BaCO3沉淀的悬浊液中,c(C
| O | 2- 3 |