摘要: 氦原子被电离一个核外电子.形成类氢结构的氦离子.已知基态的氦离子能量为.氦离子能级的示意图如图所示.在具有下列能量的光子中.不能被基太氦离子吸收而发生跃迁的是 A. 40.8eV B. 43.2eV C. 51.0eV D. 54.4eV
网址:http://m.1010jiajiao.com/timu3_id_36095[举报]
(1)人类认识原子结构的历史经历了以下几个阶段,请填写下表:
(2)19世纪末20世纪初证明原子的可分性和具有更复杂结构的重要科学发现与现象是
(3)1911年,新西兰出身的美国物理学家卢瑟福用а射线轰击极薄的金箔片,他惊奇地发现,过去一直是认为原子是“实心球”,而由这种“实心球”紧密排列而成的金箔,竟为大多数a-粒子畅通无阻地通过,就象金箔不在那儿似的,但也有极少数a-粒子发生偏转,或被笔直地弹回.根据实验事实可以对金原子结构作出一些结论.
(4)现在,科学家正在探索“反物质”.“反物质”是由“反粒子”构成的,“反粒子”与其对应的正粒子具有相同的质量与相同的电量,但电性相反.已知а粒子质量数为4、带2个正电荷的氦核,据此回答:若存在反а粒子则其组成可以表示为
查看习题详情和答案>>
| 发展阶段 | 主要化学家 | 主要贡献 |
| (1) | 道尔顿(Dalton) | 近代原子论 近代原子论 |
| (2) | 汤姆逊 汤姆逊 |
葡萄干面包模型 |
| (3) | 卢瑟福(Rutherford) | 原子结构的行星模型 原子结构的行星模型 |
| (4) | 波尔(Bohr) | 现代原子论 |
电子的发现
电子的发现
和a粒子的散射实验
a粒子的散射实验
(3)1911年,新西兰出身的美国物理学家卢瑟福用а射线轰击极薄的金箔片,他惊奇地发现,过去一直是认为原子是“实心球”,而由这种“实心球”紧密排列而成的金箔,竟为大多数a-粒子畅通无阻地通过,就象金箔不在那儿似的,但也有极少数a-粒子发生偏转,或被笔直地弹回.根据实验事实可以对金原子结构作出一些结论.
原子核带正电;原子核是一个体积很小而又很坚硬的不能穿透的核;原子几乎是一个中空的球体;(核外电子在核四周作高速运动)
原子核带正电;原子核是一个体积很小而又很坚硬的不能穿透的核;原子几乎是一个中空的球体;(核外电子在核四周作高速运动)
(4)现在,科学家正在探索“反物质”.“反物质”是由“反粒子”构成的,“反粒子”与其对应的正粒子具有相同的质量与相同的电量,但电性相反.已知а粒子质量数为4、带2个正电荷的氦核,据此回答:若存在反а粒子则其组成可以表示为
24He2-
24He2-
.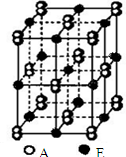 A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.A原子核外电子分处三个不同能级,且每个能级上排布的电子数相同;C原子p轨道上成对电子数等于未成对电子数;D是电负性最大的元素;E原子是元素周期表上第一个4S能级有两个电子的原子;F的核外电子数等于A、B、C、D的电子数之和.请根据以上信息,回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)
A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.A原子核外电子分处三个不同能级,且每个能级上排布的电子数相同;C原子p轨道上成对电子数等于未成对电子数;D是电负性最大的元素;E原子是元素周期表上第一个4S能级有两个电子的原子;F的核外电子数等于A、B、C、D的电子数之和.请根据以上信息,回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)(1)比较B、C的第一电离能:B
(2)将D的单质通入氢氧化钠溶液中,可得到CD2.CD2是一种无色、几乎无味的剧毒气体,可用于火箭工程助燃剂等.请回答下列问题:
①CD2中O原子的杂化轨道类型是
②与H2O分子相比,CD2分子的极性更
(3)F元素原子的核外电子排布式是
(4)A和E形成的晶体结构如右图所示,其晶体的化学式是
[选修3-物质结构与性质]
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的 一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未 成对电子;Q原子s能级与P能级电子数相等;R单质是制造各种计算机、微电子产品 的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
(1)Y原子核外共有 种不同运动状态的电子,T原子有 种不同能级的电子.
(2)X、Y、Z的第一电离能由小到大的顺序为 (用元素符号表示).
(3)由X、Y、Z形成的离子ZXY-与XZ2互为等电子体,则ZXY-中X原子的杂化轨道类 型为
(4)Z与R能形成化合物甲,1mol甲中含 mol化学键,甲与氢氟酸反应,生成 物的分子空间构型分别为
(5)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为
(6)向T的硫酸盐溶液中逐滴加入Y的氢化物的水溶液至过量,反应的离子方程式为 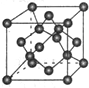
(7)X单质的晶胞如图所示,一个X晶胞中有 个X原子;若X晶体的密度为p g/cm3,阿伏加德罗常数的值为NA,则晶体中最近 的两个X原子之间的距离为 cm(用代数式表示)
查看习题详情和答案>>
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的 一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未 成对电子;Q原子s能级与P能级电子数相等;R单质是制造各种计算机、微电子产品 的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
(1)Y原子核外共有
(2)X、Y、Z的第一电离能由小到大的顺序为
(3)由X、Y、Z形成的离子ZXY-与XZ2互为等电子体,则ZXY-中X原子的杂化轨道类 型为
(4)Z与R能形成化合物甲,1mol甲中含
(5)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为
| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 | 熔点/K | 993 | 1539 | 183 |

(7)X单质的晶胞如图所示,一个X晶胞中有
(2011?山西模拟)[化学--选修物质结构与性质]
下表为长式周期表的一部分,其中的序号代表对应的元素.
(1)写出上表中元素⑨原子的外围电子排布式
(2)在元素③与①形成的水果催熟剂气体化合物中,元素③的杂化方式为
(3)元素④的第一电离能

(4)在测定元素①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是
(5)④的最高价氧化物对应的水化物稀溶液与元素⑦的单质反应时,元素④被还原到最低价,该反应的化学方程式为
(6)将过量的X通入含有元素⑩的蓝色硫酸盐溶液中,反应的离子方程式为
查看习题详情和答案>>
下表为长式周期表的一部分,其中的序号代表对应的元素.

(1)写出上表中元素⑨原子的外围电子排布式
3d54s1
3d54s1
.(2)在元素③与①形成的水果催熟剂气体化合物中,元素③的杂化方式为
sp2
sp2
杂化;元素⑦与⑧形成的化合物的晶体类型是离子晶体
离子晶体
.(3)元素④的第一电离能
>
>
⑤(填写“>”、“=”或“<”)的第一电离能;元素④与元素①形成的X分子的空间构型为三角锥形
三角锥形
.请写出与元素④的单质互为等电子体分子、离子的化学式CO、C22-
CO、C22-
(各写一种).
(4)在测定元素①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是
HF分子间会形成氢键
HF分子间会形成氢键
.(5)④的最高价氧化物对应的水化物稀溶液与元素⑦的单质反应时,元素④被还原到最低价,该反应的化学方程式为
4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O
4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O
.(6)将过量的X通入含有元素⑩的蓝色硫酸盐溶液中,反应的离子方程式为
Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+
Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+
;元素⑩的某种氧化物的晶体结构如图所示,其中实心球表示元素⑩原子,则一个晶胞中所包含的氧原子数目为2
2
.(《物质结构与性质》)
(1)金属镁有许多重要的用途,法国化学家维多克?格利雅因发明了在有机合成方面用途广泛的格利雅试剂而荣获诺贝尔化学奖,格利雅试剂的结构简式可表示为RMgX,它是金属镁和卤代烃反应的产物,简称格氏试剂,它在醚的稀溶液中以单体形式存在,并与二分子醚络合,在浓溶液中以二聚体存在,结构如图:
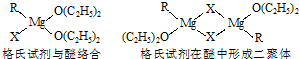
①上述2种结构中均存在配位键,把你认为是配位键的用“→”标出 .
②由原子间的成键特点,可以预测中心原子Mg的杂化类型可能为 ;Mg原子的核外电子排布式可表示为 .
③下列比较中正确的是
A.金属键的强弱:Mg>Al B.基态原子第一电离能:Mg>Al
C.金属性:Mg>Al D.晶格能:NaCl>MgCl2
(2)将TiCl4在氩气保护下与镁共热得到钛:TiCl4+2Mg
Ti+2MgCl2
①Ti元素在元素周期表中的位置是 ,钛原子的外围电子排布式为 .
②TiCl4在常温下是无色液体,在水或潮湿空气中易水解而冒白烟.则TiCl4属于 (填“原子”、“分子”或“离子”)晶体.
③二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化.有关甲醛、苯、二氧化碳及水说法正确的是 .
A.苯与B3N3H6互为等电子体
B.甲醛、苯分子中碳原子均采用sp2杂化
C.苯、二氧化碳是非极性分子,水和甲醛是极性分子
D.水的沸点比甲醛高得多,是因为水分子间能形成氢键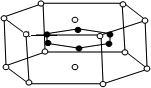
(3)2001年报导的硼和镁形成的化合物刷新了金属化合物超导温度的最高纪录.如图中示意的该化合物的晶体结构单元:镁原子间形成正六棱柱,则棱柱的上下底面还各有一个镁原子,六个硼原子位于棱柱内,则该化合物的化学式可表示为
A.MgB B.MgB2 C.Mg2B D.Mg3B2.
查看习题详情和答案>>
(1)金属镁有许多重要的用途,法国化学家维多克?格利雅因发明了在有机合成方面用途广泛的格利雅试剂而荣获诺贝尔化学奖,格利雅试剂的结构简式可表示为RMgX,它是金属镁和卤代烃反应的产物,简称格氏试剂,它在醚的稀溶液中以单体形式存在,并与二分子醚络合,在浓溶液中以二聚体存在,结构如图:

①上述2种结构中均存在配位键,把你认为是配位键的用“→”标出
②由原子间的成键特点,可以预测中心原子Mg的杂化类型可能为
③下列比较中正确的是
A.金属键的强弱:Mg>Al B.基态原子第一电离能:Mg>Al
C.金属性:Mg>Al D.晶格能:NaCl>MgCl2
(2)将TiCl4在氩气保护下与镁共热得到钛:TiCl4+2Mg
| ||
①Ti元素在元素周期表中的位置是
②TiCl4在常温下是无色液体,在水或潮湿空气中易水解而冒白烟.则TiCl4属于
③二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化.有关甲醛、苯、二氧化碳及水说法正确的是
A.苯与B3N3H6互为等电子体
B.甲醛、苯分子中碳原子均采用sp2杂化
C.苯、二氧化碳是非极性分子,水和甲醛是极性分子
D.水的沸点比甲醛高得多,是因为水分子间能形成氢键

(3)2001年报导的硼和镁形成的化合物刷新了金属化合物超导温度的最高纪录.如图中示意的该化合物的晶体结构单元:镁原子间形成正六棱柱,则棱柱的上下底面还各有一个镁原子,六个硼原子位于棱柱内,则该化合物的化学式可表示为
A.MgB B.MgB2 C.Mg2B D.Mg3B2.