摘要:33.原溶液为2mg.含NaOH:
网址:http://m.1010jiajiao.com/timu3_id_359711[举报]
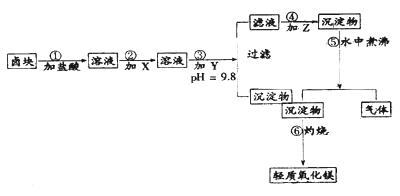
“卤块”的主要成分为MgCl2(含Fe2+、Fe3+、Mn2+等杂质离子),若以它为原料,按如下工艺流程图,即可制得“轻质氧化镁”。如果要求产品尽量不含杂质离子,而且成本较低,流程中所用试剂或pH值控制可参考下列附表确定。轻质氧化镁工艺流程图如下:

表1 化学试剂价格表
| 试剂 | 价格(元/ t ) |
| 漂液(含NaClO25.2%) H2O2(30%) NaOH(固98%) Na2CO3(固99.5%) 卤块(MgCl2,30%) | 450 2400 2100 600 310 |
表2 生成氢氧化物沉淀的值

| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 Fe(OH)2 Mn(OH)2 Mg(OH)2 | 2.7 7.6 8.3 9.  6 6 | 3.7 9.6Ω 9.8 11.1 |
⑴、在步骤②加入试剂X,最佳选择应是 ,其作用是 。
⑵、在步骤③加入的试剂Y应是 ,之所以要控制pH=9.8,其目的
是 。
⑶、在步骤⑤时发生的化学反应方程式是: 。 查看习题详情和答案>>
“卤块”的主要成分为MgCl2(含Fe2+、Fe3+、Mn2+等杂质离子),若以它为原料,按如下工艺流程图,即可制得“轻质氧化镁”。如果要求产品尽量不含杂质离子,而且成本较低,流程中所用试剂或PH值控制可参考下列附表确定
轻质氧化镁生产工艺流程图
表1 生成氢氧化物沉淀的PH值
*)注:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常常将它氧化成为Fe3+,生成
Fe(OH)3沉淀而去除之。
表2 化学试剂价值表
请填写以下空白:
(1)在步骤②加入的试剂X,最佳选择应是 ,其作用是 。
(2)步骤③加入的试剂Y应是 ;之所以要控制pH=9.8,其目的是 。
(3)在步骤⑤时发生的化学反应方程式是:

轻质氧化镁生产工艺流程图
表1 生成氢氧化物沉淀的PH值
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 Fe(OH)2 Mn(OH)2 Mg(OH)2 | 2.7 7.6 8.3 9.6 | 3.7 9.6 9.8 11.1 |
Fe(OH)3沉淀而去除之。
表2 化学试剂价值表
| 试剂 | 价格(元/t) |
| 漂液(含NaClO25.2%) H2O2(30%) NaOH(固98%) Na2CO3(固99.5%) 卤块(MgCl2,30%) | 450 2400 2100 600 310 |
(1)在步骤②加入的试剂X,最佳选择应是 ,其作用是 。
(2)步骤③加入的试剂Y应是 ;之所以要控制pH=9.8,其目的是 。
(3)在步骤⑤时发生的化学反应方程式是:
(2010?扬州模拟)多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它对环境污染很大,能遇水强烈水解,放出大量的热.研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成份为BaCO3,且含有钙、铁、镁等离子)制备BaCl2?2H2O,工艺流程如下.已知常温下Fe3+、Mg2+完全沉淀的pH分别是:3.4、12.4.
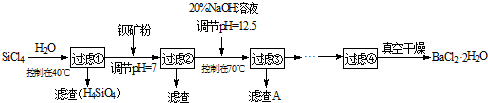
(1)SiCl4水解控制在40℃以下的原因是
已知:SiCl4(s)+H2(g)=SiHCl3(s)+HCl(g)△H1=+47kJ/mol;SiHCl3(s)+H2(g)=Si(s)+3HCl(g)△H2=+189kJ/mol
则由SiCl4制备硅的热化学方程式为
(2)加钡矿粉时生成BaCl2的离子反应方程式是
(3)加20% NaOH调节pH=12.5,得到滤渣A的主要成分是
(4)BaCl2滤液经蒸发浓缩、降温结晶、过滤,再经真空干燥后得到?2H2O.实验室中蒸发浓缩用到的含硅酸盐的仪器有
(5)为体现该工艺的绿色化学思想,该工艺中能循环利用的物质是
查看习题详情和答案>>

(1)SiCl4水解控制在40℃以下的原因是
防止HCl挥发污染环境或控制SiCl4的水解速率,防止反应过于剧烈
防止HCl挥发污染环境或控制SiCl4的水解速率,防止反应过于剧烈
.已知:SiCl4(s)+H2(g)=SiHCl3(s)+HCl(g)△H1=+47kJ/mol;SiHCl3(s)+H2(g)=Si(s)+3HCl(g)△H2=+189kJ/mol
则由SiCl4制备硅的热化学方程式为
SiCl4(s)+2H2(g)=Si(s)+4HCl(g)△H=+236kJ/mol
SiCl4(s)+2H2(g)=Si(s)+4HCl(g)△H=+236kJ/mol
.(2)加钡矿粉时生成BaCl2的离子反应方程式是
BaCO3+2H+=Ba2++CO2+H2O↑
BaCO3+2H+=Ba2++CO2+H2O↑
.(3)加20% NaOH调节pH=12.5,得到滤渣A的主要成分是
Mg(OH)2、Ca(OH)2
Mg(OH)2、Ca(OH)2
,控制温度70℃的目的是确保钙离子完全除去(或温度越高,Ca(OH)2溶解度越小)
确保钙离子完全除去(或温度越高,Ca(OH)2溶解度越小)
.(4)BaCl2滤液经蒸发浓缩、降温结晶、过滤,再经真空干燥后得到?2H2O.实验室中蒸发浓缩用到的含硅酸盐的仪器有
3
3
种.(5)为体现该工艺的绿色化学思想,该工艺中能循环利用的物质是
BaCl2溶液
BaCl2溶液
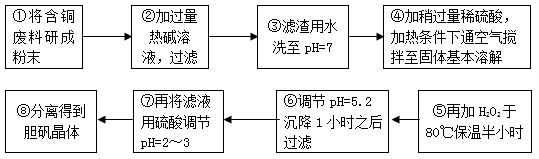
.(12分)工业上需要利用一批回收的含铜废料制造胆矾(CuSO4·5H2O)。该废料中各种成份含量如下:Cu和CuO约占87%,其它为Al、Fe、Si及其氧化物,还有少量的难溶物质。工艺流程为:
部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH如下表:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 | Fe(OH)2 |
| pH | 5.2 | 3.1 | 6.7 | 9.4 | 9.7 |
(1)步骤①中为什么要将含铜废料研磨成粉状?
 。
。(2)步骤⑤中H2O2参加反应的离子方程式:
 。
。(3)步骤⑥中调节溶液pH时适宜的物质是 。(填序号);
A.NaOH B.氨水 C.Cu2(OH)2CO3 D.Cu(OH)2 E.MgCO3
步骤⑥中滤渣成份的化学式 。
(4)步骤⑦中用硫酸调节pH=2~3的原因是 。
(5)步骤⑧的分离操作是: , 冷却结晶, 。 查看习题详情和答案>>
(12分)工业上需要利用一批回收的含铜废料制造胆矾(CuSO4·5H2O)。该废料中各种成份含量如下:Cu和CuO约占87%,其它为Al、Fe、Si及其氧化物,还有少量的难溶物质。工艺流程为:
部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH如下表:
回答:
(1)步骤①中为什么要将含铜废料研磨成粉状?
 。
。
(2)步骤⑤中H2O2参加反应的离子方程式: 。
。
(3)步骤⑥中调节溶液pH时适宜的物质是 。(填序号);
A.NaOH B.氨水 C.Cu2(OH)2CO3 D.Cu(OH)2 E.MgCO3
步骤⑥中滤渣成份的化学式 。
(4)步骤⑦中用硫酸调节pH=2~3的原因是 。
(5)步骤⑧的分离操作是: , 冷却结晶, 。

部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH如下表:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 | Fe(OH)2 |
| pH | 5.2 | 3.1 | 6.7 | 9.4 | 9.7 |
(1)步骤①中为什么要将含铜废料研磨成粉状?
 。
。(2)步骤⑤中H2O2参加反应的离子方程式:
 。
。(3)步骤⑥中调节溶液pH时适宜的物质是 。(填序号);
A.NaOH B.氨水 C.Cu2(OH)2CO3 D.Cu(OH)2 E.MgCO3
步骤⑥中滤渣成份的化学式 。
(4)步骤⑦中用硫酸调节pH=2~3的原因是 。
(5)步骤⑧的分离操作是: , 冷却结晶, 。