题目内容
(2010?扬州模拟)多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它对环境污染很大,能遇水强烈水解,放出大量的热.研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成份为BaCO3,且含有钙、铁、镁等离子)制备BaCl2?2H2O,工艺流程如下.已知常温下Fe3+、Mg2+完全沉淀的pH分别是:3.4、12.4.
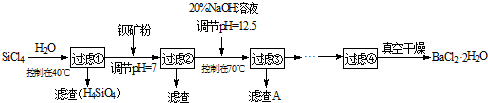
(1)SiCl4水解控制在40℃以下的原因是
已知:SiCl4(s)+H2(g)=SiHCl3(s)+HCl(g)△H1=+47kJ/mol;SiHCl3(s)+H2(g)=Si(s)+3HCl(g)△H2=+189kJ/mol
则由SiCl4制备硅的热化学方程式为
(2)加钡矿粉时生成BaCl2的离子反应方程式是
(3)加20% NaOH调节pH=12.5,得到滤渣A的主要成分是
(4)BaCl2滤液经蒸发浓缩、降温结晶、过滤,再经真空干燥后得到?2H2O.实验室中蒸发浓缩用到的含硅酸盐的仪器有
(5)为体现该工艺的绿色化学思想,该工艺中能循环利用的物质是

(1)SiCl4水解控制在40℃以下的原因是
防止HCl挥发污染环境或控制SiCl4的水解速率,防止反应过于剧烈
防止HCl挥发污染环境或控制SiCl4的水解速率,防止反应过于剧烈
.已知:SiCl4(s)+H2(g)=SiHCl3(s)+HCl(g)△H1=+47kJ/mol;SiHCl3(s)+H2(g)=Si(s)+3HCl(g)△H2=+189kJ/mol
则由SiCl4制备硅的热化学方程式为
SiCl4(s)+2H2(g)=Si(s)+4HCl(g)△H=+236kJ/mol
SiCl4(s)+2H2(g)=Si(s)+4HCl(g)△H=+236kJ/mol
.(2)加钡矿粉时生成BaCl2的离子反应方程式是
BaCO3+2H+=Ba2++CO2+H2O↑
BaCO3+2H+=Ba2++CO2+H2O↑
.(3)加20% NaOH调节pH=12.5,得到滤渣A的主要成分是
Mg(OH)2、Ca(OH)2
Mg(OH)2、Ca(OH)2
,控制温度70℃的目的是确保钙离子完全除去(或温度越高,Ca(OH)2溶解度越小)
确保钙离子完全除去(或温度越高,Ca(OH)2溶解度越小)
.(4)BaCl2滤液经蒸发浓缩、降温结晶、过滤,再经真空干燥后得到?2H2O.实验室中蒸发浓缩用到的含硅酸盐的仪器有
3
3
种.(5)为体现该工艺的绿色化学思想,该工艺中能循环利用的物质是
BaCl2溶液
BaCl2溶液
.分析:(1)氯化硅水解生成原硅酸和氯化氢;温度越高,氯化硅的水解速率越大,氯化氢的挥发越强;将两个方程式相加即得则由SiCl4制备硅的热化学方程式,注意焓变进行相应的改变;
(2)钡矿粉时生成BaCl2是碳酸钡溶解于酸中反应生成;
(3)根据氢氧化铁和氢氧化镁完全沉淀所需溶液的PH值,氢氧化钙溶解度随温度升高减小确定滤渣A的成分;温度是为了除去钙离子;
(4)蒸发浓缩用到的含硅酸盐的仪器为玻璃仪器;根据从溶液中析出固体的方法分析解答.
(5)循环利用是过程中生成的物质可以再用在制备流程中的原料.
(2)钡矿粉时生成BaCl2是碳酸钡溶解于酸中反应生成;
(3)根据氢氧化铁和氢氧化镁完全沉淀所需溶液的PH值,氢氧化钙溶解度随温度升高减小确定滤渣A的成分;温度是为了除去钙离子;
(4)蒸发浓缩用到的含硅酸盐的仪器为玻璃仪器;根据从溶液中析出固体的方法分析解答.
(5)循环利用是过程中生成的物质可以再用在制备流程中的原料.
解答:解:(1)氯化硅水解生成原硅酸和氯化氢,水解方程式为SiCl4+4H2O=H4SiO4↓+4HCl,温度高时,氯化硅的水解速率增大,氯化氢的挥发增强,且氯化氢能污染环境,温度较低时,能防止HCl挥发污染环境或控制SiCl4的水解速率,防止反应过于剧烈,
由盖斯定律可知:将方程式SiCl4(s)+H2(g)=SiHCl3(s)+HCl(g)△H1=+47kJ/mol和SiHCl3(s)+H2(g)=Si(s)+3HCl(g)△H2=+189kJ/mol相加得SiCl4(s)+2H2(g)=Si(s)+4HCl(g)△H=+236kJ/mol,
故答案为:防止HCl挥发污染环境或控制SiCl4的水解速率,防止反应过于剧烈;SiCl4(s)+2H2(g)=Si(s)+4HCl(g)△H=+236kJ/mol;
(2)碳酸钡和盐酸反应生成氯化钡,反应的两种方程式为:BaCO3+2H+=Ba2++CO2+H2O↑,故答案为:BaCO3+2H+=Ba2++CO2+H2O↑;
(3)当pH=3.4时,铁离子完全生成沉淀,当pH=12.4时,镁离子完全沉淀生成氢氧化镁,Mg(OH)2,所以当pH=12.5时,滤渣A的成分是氢氧化镁,氢氧化钙;控制温度70℃的目的是确保钙离子完全除去,故答案为:Mg(OH)2,Ca(OH)2;确保钙离子完全除去(或温度越高,Ca(OH)2溶解度越小);
(4)从溶液中制取固体的方法是:蒸发浓缩→冷却结晶→过滤→洗涤,实验室中蒸发浓缩用到的含硅酸盐的仪器即为玻璃仪器,有蒸发皿、玻璃棒,酒精灯,故答案为:3;
(5)依据流程分析可知,该工艺中能循环利用的物质是BaCl2溶液,故答案为:BaCl2溶液.
由盖斯定律可知:将方程式SiCl4(s)+H2(g)=SiHCl3(s)+HCl(g)△H1=+47kJ/mol和SiHCl3(s)+H2(g)=Si(s)+3HCl(g)△H2=+189kJ/mol相加得SiCl4(s)+2H2(g)=Si(s)+4HCl(g)△H=+236kJ/mol,
故答案为:防止HCl挥发污染环境或控制SiCl4的水解速率,防止反应过于剧烈;SiCl4(s)+2H2(g)=Si(s)+4HCl(g)△H=+236kJ/mol;
(2)碳酸钡和盐酸反应生成氯化钡,反应的两种方程式为:BaCO3+2H+=Ba2++CO2+H2O↑,故答案为:BaCO3+2H+=Ba2++CO2+H2O↑;
(3)当pH=3.4时,铁离子完全生成沉淀,当pH=12.4时,镁离子完全沉淀生成氢氧化镁,Mg(OH)2,所以当pH=12.5时,滤渣A的成分是氢氧化镁,氢氧化钙;控制温度70℃的目的是确保钙离子完全除去,故答案为:Mg(OH)2,Ca(OH)2;确保钙离子完全除去(或温度越高,Ca(OH)2溶解度越小);
(4)从溶液中制取固体的方法是:蒸发浓缩→冷却结晶→过滤→洗涤,实验室中蒸发浓缩用到的含硅酸盐的仪器即为玻璃仪器,有蒸发皿、玻璃棒,酒精灯,故答案为:3;
(5)依据流程分析可知,该工艺中能循环利用的物质是BaCl2溶液,故答案为:BaCl2溶液.
点评:本题考查了物质制备流程分析判断,物质性质的应用,盐类水解、沉淀形成条件,杂质除去方法,试剂选择,离子方程式书写,盖斯定律应用,题目难度中等.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
