网址:http://m.1010jiajiao.com/timu3_id_359386[举报]
将m1g该黄铁矿石的样品放入如下图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全.其反应的化学方程式为:
4FeS2+11O2
| ||
4FeS+7O2
| ||
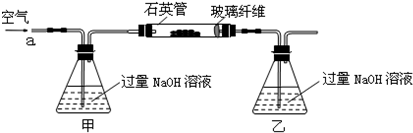
实验一:测定硫元素的含量
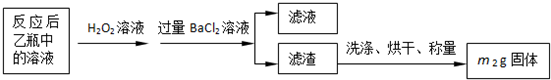
反应结束后,将乙瓶中的溶液进行如下处理:
(1)甲、乙两装置的作用分别是
乙瓶内发生反应的离子方程式为
(2)反应后乙瓶中的溶液需加足量H2O2溶液的目的是
(3)该黄铁矿石中硫元素的质量分数为
| 32m2 |
| 233m1 |
| 32m2 |
| 233m1 |
实验二:测定铁元素的含量
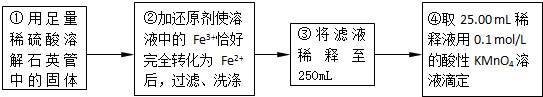
(4)②中,若用铁粉作还原剂,则所测得的铁元素的含量
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有
(6)某同学一共进行了三次滴定实验,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗KMnO4溶液体积/mL | 25.00 | 25.03 | 24.97 |
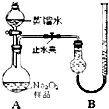 (2011?宁德一模)某化学研究小组为测定Na2O2样品(仅含Na2O杂质)的纯度,设计了两种实验方案进行探究.
(2011?宁德一模)某化学研究小组为测定Na2O2样品(仅含Na2O杂质)的纯度,设计了两种实验方案进行探究.[实验一]取样品0.100g,用如图所示实验装置进行测定.(夹持装置省略)
(1)检查装置A气密性的方法是
(2)若在实验过程中共产生气体11.20mL(已折算成标准状况),则样品中Na2O2的纯度为
[实验二]样品溶于水后用盐酸滴定
(3)取一定量样品溶于水并稀释至250mL,配制时,所用到的玻璃仪器除了烧杯和玻璃棒外,还需用到
(4)取上述所配溶液各25.00mL,用一定浓度的标准盐酸滴定,平行实验记录如下表:
| 实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 标准盐酸体积(mL) | 23.00 | 24.98 | 25.00 | 25.02 |
[实验分析]实验结果对比分析
(5)小组同学对比两个实验发现,实验一测得的Na2O2样品的纯度比理论值明显偏小.经过分析,小组同学认为,明显偏差不是由操作失误和装置缺陷引起的,可能是反应原理上的原因.查阅资料发现:Na2O2与水反应产生的H2O2未完全分解.
①写出Na2O2与水生成H2O2的化学方程式
②若将实验一稍加改进,就能使测定结果接近理论值,写出改进方案:
(1)写出试管内溶液中发生反应的化学方程式
(2)在实验过程中观察到试管内的溶液呈
(3)乙同学认为甲虽然收集到的气体是一氧化氮,但并不能说明反应中一定生成一氧化氮.他的理由是
有关化学方程式为:
(4)丙同学釆用如图Ⅱ所示装置进行实验,证明了铜与稀硝酸反应生成一氧化氮.该同学的步骤如下表所示,请回答实验中的有关问题.
| 实验步骤 | 问题 |
| 1从U型管左端加入稀硝酸直至充满U型管右端 | ∥/ |
| 2用附有铜丝的胶塞塞住U型管右端,观察现象 | 现象是 有无色气体产生,右边溶液逐渐变成绿色 有无色气体产生,右边溶液逐渐变成绿色 |
| 3待反应停止后打开胶塞,观察实验现象 | 现象是 无色气体与空气接触后立即变成红棕色 无色气体与空气接触后立即变成红棕色 |
(6)丁同学用图Ⅲ所示装置代替图Ⅱ中U型管右端的附有铜丝的胶塞进行实验,待反应停止后将一氧化氮气体排入分液漏斗中,观察到的实验现象与丙同学实验的第
(7)实验结束后丁同学向分液漏斗中注入适量水并充分振荡,试写出发生的化学反应方程式
(8)若将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2L(不考虑NO2的反应),试回答:
①若铜与硝刚好反应完全,则原硝酸溶液的物质的量浓度为
②将产生的气体全部释放后,向溶液中加入VmL amol?L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化为沉淀,则原硝酸溶液的物质的量浓度为
| 10-3a﹒V +0.5 |
| 0.14 |
| 10-3a﹒V +0.5 |
| 0.14 |
③已知NO和NO2的混合气与足量氧气混合后能被水完全吸收成硝酸,则要使上述11.2L气体完全被水吸收成硝酸,理论上需消耗标准状况下的氧气
3Cu+8HNO3=3Cu(NO3 ) 2+2NO↑+4H2O
3 2
1.5xmol xmol
Cu+4HNO3(浓)=Cu(NO3 ) 2+2NO2↑+2H2O
1 2
| 1 |
| 2 |
所以方程组为
|
所以
|
即一氧化氮为0.26mol,二氧化氮为0.24mol.
4NO+2H2O+3O2=4HNO3
4 3
0.26mol 0.195mol
4 NO2+2H2O+O2=4HNO3
41
0.24mol 0.06mol
所以需要氧气0.195mol+0.06mol=0.255mol,体积为0.255mol×22.4L/mol=5.71L
3Cu+8HNO3=3Cu(NO3 ) 2+2NO↑+4H2O
3 2
1.5xmol xmol
Cu+4HNO3(浓)=Cu(NO3 ) 2+2NO2↑+2H2O
1 2
| 1 |
| 2 |
所以方程组为
|
所以
|
即一氧化氮为0.26mol,二氧化氮为0.24mol.
4NO+2H2O+3O2=4HNO3
4 3
0.26mol 0.195mol
4 NO2+2H2O+O2=4HNO3
41
0.24mol 0.06mol
所以需要氧气0.195mol+0.06mol=0.255mol,体积为0.255mol×22.4L/mol=5.71L
(共6分)实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:

|
实验次数 |
起始温度t1/℃ |
终止温度t2/℃ |
|
|
盐酸 |
NaOH溶液 |
||
|
1 |
20.2 |
20.3 |
23.7 |
|
2 |
20.3 |
20.5 |
23.8 |
|
3 |
21.5 |
21.6 |
24.9 |
完成下列问题:
(1)实验时不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是 。
(2)在操作正确的前提下,提高中和热测定准确性的关键是 。
(3)根据上表中所测数据进行计算,则该实验测得的中和热ΔH= [盐酸和NaOH溶液的密度按1 g·cm-3计算,反应后混合溶液的比热容(c)按4.18 J·(g·℃)-1计算]。如用0.5 mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将 (填“偏大”、“偏小”、 “不变”)。
(4)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.在量取盐酸时仰视计数
F.大烧杯的盖板中间小孔太大
查看习题详情和答案>>
(10分)
I.(4分)某温度下的溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L。x与y的关系如图所示:

(1)该温度下,中性溶液的pH= 。
(2)该温度下0.01 mol/L NaOH溶液的pH= 。
II. (6分)某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
|
温度(℃) |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
|
平衡总压强(kPa) |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
|
平衡气体总浓度 (×10-3mol/L) |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
①可以判断该分解反应已经达到化学平衡的是 (填字母)。
A.2v(NH3)=v(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,计算25.0℃时的分解平衡常数为 。
(2)已知:NH2COONH4+2H2O NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。
NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。

③计算25℃时,0~6min氨基甲酸铵水解反应的平均速率为 。
④根据图中信息,如何说明水解反应的平均速率随温度升高而增大:
。
查看习题详情和答案>>