题目内容
 (2011?宁德一模)某化学研究小组为测定Na2O2样品(仅含Na2O杂质)的纯度,设计了两种实验方案进行探究.
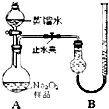
(2011?宁德一模)某化学研究小组为测定Na2O2样品(仅含Na2O杂质)的纯度,设计了两种实验方案进行探究.[实验一]取样品0.100g,用如图所示实验装置进行测定.(夹持装置省略)
(1)检查装置A气密性的方法是
夹紧止水夹,向分液漏斗中加水,旋开活塞,一段时间后,若水不能顺利流下,证明气密性良好;或者关闭分液漏斗活塞,右侧的导管插入水中,用手捂住分液漏斗,看是否有气泡产生,冷却后是否有一段水柱形成
夹紧止水夹,向分液漏斗中加水,旋开活塞,一段时间后,若水不能顺利流下,证明气密性良好;或者关闭分液漏斗活塞,右侧的导管插入水中,用手捂住分液漏斗,看是否有气泡产生,冷却后是否有一段水柱形成
.(2)若在实验过程中共产生气体11.20mL(已折算成标准状况),则样品中Na2O2的纯度为
78%
78%
.[实验二]样品溶于水后用盐酸滴定
(3)取一定量样品溶于水并稀释至250mL,配制时,所用到的玻璃仪器除了烧杯和玻璃棒外,还需用到
250 mL容量瓶、胶头滴管
250 mL容量瓶、胶头滴管
.(4)取上述所配溶液各25.00mL,用一定浓度的标准盐酸滴定,平行实验记录如下表:
| 实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 标准盐酸体积(mL) | 23.00 | 24.98 | 25.00 | 25.02 |
25.00
25.00
mL.若滴定前用上述所配溶液润洗锥形瓶,对实验测定结果产生的影响是偏高
偏高
(填“偏高”、“偏低”或“无影响”).[实验分析]实验结果对比分析
(5)小组同学对比两个实验发现,实验一测得的Na2O2样品的纯度比理论值明显偏小.经过分析,小组同学认为,明显偏差不是由操作失误和装置缺陷引起的,可能是反应原理上的原因.查阅资料发现:Na2O2与水反应产生的H2O2未完全分解.
①写出Na2O2与水生成H2O2的化学方程式
Na2O2+2H2O=2NaOH+H2O2
Na2O2+2H2O=2NaOH+H2O2
.②若将实验一稍加改进,就能使测定结果接近理论值,写出改进方案:
反应前向Na2O2样品中加入少量MnO2
反应前向Na2O2样品中加入少量MnO2
.分析:(1)检查装置A气密性主要是防止活塞处漏气,所以要夹紧止水夹,向分液漏斗中加水,旋开活塞,一段时间后,若水不能顺利流下,证明气密性良好;或者关闭分液漏斗活塞,右侧的导管插入水中,用手捂住分液漏斗,看是否有气泡产生,冷却后是否有一段水柱形成;
(2)生成气体为氧气,根据n=
计算氧气的物质的量,进而计算过氧化钠的物质的量,计算过氧化钠的质量,根据质量分数定义计算;
(3)稀释至250 mL,需用到250 mL容量瓶,定容时还需要用到胶头滴管;
(4)由表中数据可知,第一组数据误差大,要舍去,根据后三组数据计算平均值;
若滴定前用上述所配溶液润洗锥形瓶,相当于增加了待测液的量,滴定液会增多,则需要的盐酸体积增多,计算时会认为氧化钠偏多,过氧化钠的质量分数会偏低,这里说的实验测定结果指的是盐酸的体积会偏高;
(5)①Na2O2与水生成H2O2方程式是Na2O2+2H2O=2NaOH+H2O2;
②实验一改进的目的是使过氧化氢分解,一般加入使过氧化氢快速分解的催化剂,如二氧化锰,氯化铁等均可.
(2)生成气体为氧气,根据n=
| V |
| Vm |
(3)稀释至250 mL,需用到250 mL容量瓶,定容时还需要用到胶头滴管;
(4)由表中数据可知,第一组数据误差大,要舍去,根据后三组数据计算平均值;
若滴定前用上述所配溶液润洗锥形瓶,相当于增加了待测液的量,滴定液会增多,则需要的盐酸体积增多,计算时会认为氧化钠偏多,过氧化钠的质量分数会偏低,这里说的实验测定结果指的是盐酸的体积会偏高;
(5)①Na2O2与水生成H2O2方程式是Na2O2+2H2O=2NaOH+H2O2;
②实验一改进的目的是使过氧化氢分解,一般加入使过氧化氢快速分解的催化剂,如二氧化锰,氯化铁等均可.
解答:解:(1)检查装置A气密性主要是防止活塞处漏气,具体检验方法为:夹紧止水夹,向分液漏斗中加水,旋开活塞,一段时间后,若水不能顺利流下,证明气密性良好;或者关闭分液漏斗活塞,右侧的导管插入水中,用手捂住分液漏斗,看是否有气泡产生,冷却后是否有一段水柱形成,
故答案为:夹紧止水夹,向分液漏斗中加水,旋开活塞,一段时间后,若水不能顺利流下,证明气密性良好;或者关闭分液漏斗活塞,右侧的导管插入水中,用手捂住分液漏斗,看是否有气泡产生,冷却后是否有一段水柱形成;
(2)气体11.20 mL,说明氧气为
=0.0005mol,则过氧化钠为0.0005mol×2=0.001mol,质量为0.001mol×78g/mol=0.078g,故过氧化钠的质量分数为
×100%=78%,
故答案为:78%;
(3)稀释至250 mL,需用到250 mL容量瓶,定容时还需要用到胶头滴管,
故答案为:250 mL容量瓶、胶头滴管;
(4)由表中数据可知,第一组数据误差大,要舍去,用后三组计算平均值是
=25.00mL;
若滴定前用上述所配溶液润洗锥形瓶,相当于增加了待测液的量,滴定液会增多,则需要的盐酸体积增多,计算时会认为氧化钠偏多,过氧化钠的质量分数会偏低,这里说的实验测定结果指的是盐酸的体积会偏高,
故答案为:25.00;偏高.
(5)①Na2O2与水生成H2O2方程式是Na2O2+2H2O=2NaOH+H2O2,
故答案为:Na2O2+2H2O=2NaOH+H2O2;
②实验一改进的目的是使过氧化氢分解,一般加入使过氧化氢快速分解的催化剂,如二氧化锰等均可,
故答案为:反应前向Na2O2样品中加入少量MnO2.
故答案为:夹紧止水夹,向分液漏斗中加水,旋开活塞,一段时间后,若水不能顺利流下,证明气密性良好;或者关闭分液漏斗活塞,右侧的导管插入水中,用手捂住分液漏斗,看是否有气泡产生,冷却后是否有一段水柱形成;
(2)气体11.20 mL,说明氧气为
| 0.0112L |
| 22.4L/mol |
| 0.078g |
| 0.1g |
故答案为:78%;
(3)稀释至250 mL,需用到250 mL容量瓶,定容时还需要用到胶头滴管,
故答案为:250 mL容量瓶、胶头滴管;
(4)由表中数据可知,第一组数据误差大,要舍去,用后三组计算平均值是
| 24.98mL+25.00mL+25.02mL |
| 3 |
若滴定前用上述所配溶液润洗锥形瓶,相当于增加了待测液的量,滴定液会增多,则需要的盐酸体积增多,计算时会认为氧化钠偏多,过氧化钠的质量分数会偏低,这里说的实验测定结果指的是盐酸的体积会偏高,
故答案为:25.00;偏高.
(5)①Na2O2与水生成H2O2方程式是Na2O2+2H2O=2NaOH+H2O2,
故答案为:Na2O2+2H2O=2NaOH+H2O2;
②实验一改进的目的是使过氧化氢分解,一般加入使过氧化氢快速分解的催化剂,如二氧化锰等均可,
故答案为:反应前向Na2O2样品中加入少量MnO2.
点评:本题考查学生实验能力以及过氧化钠的性质,涉及定量测定物质的纯度、气密性的检验、实验数据的处理能力、中和滴定操作方法及误差分析,要求学生具有分析和解决问题的能力,难度中等.

练习册系列答案
相关题目
 (2011?宁德一模)已知X、Y、Z、E、F五种常见物质含有同一元素M,在一定条件下它们有如图转化关系,Z是NO,下列推断不合理的是( )
(2011?宁德一模)已知X、Y、Z、E、F五种常见物质含有同一元素M,在一定条件下它们有如图转化关系,Z是NO,下列推断不合理的是( )