摘要:3.李斌的经历告诉我们.人才是多种多样的.每个人都应该立志成为某一方面的人才.实现人生的应有价值.为此.我们一定要( ). ①考上名牌大学 ②认识自己的个性特点.确定成才方向 ③选择热门专业 ④把个人机遇与国家.民族机遇联系起来 A.①③ B.②④ C.②③ D.①④
网址:http://m.1010jiajiao.com/timu3_id_35905[举报]
不同元素的原子在分子内吸引电子的能力大小可用一定数值x来表示,x越大,其原子吸引电子的能力越强. 下面是某些短周期元素的x值:
(1)通过分析x值变化规律,确定Mg的x值范围:
(2)推测x值与原子半径的关系是
(3)分别指出下列两种化合物中氧元素的化合价:HClO
(4)经验规律告诉我们:当成键的两原子相应元素x数值的差值(△x),当△x>1.7时,一般为离子键,当△x<1.7时,一般为共价键,试推断AlBr3中化学键类型是
(5)预测元素周期表中,x值最小的元素位于
查看习题详情和答案>>
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| x值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
0.93
0.93
<x(Mg)<1.57
1.57
.(2)推测x值与原子半径的关系是
同周期(同主族)中,x值大,其原子半径越小
同周期(同主族)中,x值大,其原子半径越小
;根据短周期元素的x值变化特点,体现了元素性质的周期性
周期性
变化规律.(3)分别指出下列两种化合物中氧元素的化合价:HClO
-2
-2
,HFO0
0
.(4)经验规律告诉我们:当成键的两原子相应元素x数值的差值(△x),当△x>1.7时,一般为离子键,当△x<1.7时,一般为共价键,试推断AlBr3中化学键类型是
共价键
共价键
.(5)预测元素周期表中,x值最小的元素位于
第六
第六
周期第IA
第IA
族(放射性元素除外).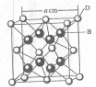 (2011?咸阳模拟)[化学-选修物质结构与性质]
(2011?咸阳模拟)[化学-选修物质结构与性质]已知A、B、C、D和E都是元素周期表中前20号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期也不在同一主族.B原子的L层有1对成对电子且其单质是空气的主要成分.C原子的L层p轨道中有5个电子;D是周期表中1--18列中的第14列元素;D元素原子次外层电子数与最外层电子数之比为4:1. E跟C可形成离子化合物,其晶胞结构如右图.请回答:
(1)A与D形成的最简单化合物的分子式是
SiH4
SiH4
,该分子的立体构型是正四面体
正四面体
.该分子属于非极
非极
(填“极性”或“非极性”)分子(2)C与D形成的化合物晶体类型是
分子晶体
分子晶体
.B单质分子中含1
1
个σ键2
2
个π键(3)C的电子排布图
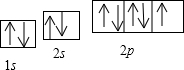

(4)从上图中可以看出,E踉C形成的化合物的化学式为
CaF2
CaF2
;若设该晶胞的边长为a cm,则该离子化合物晶体的密度是
| ||
| a3cm3 |
| ||
| a3cm3 |
(5)电负性(用X表示)也是元素的一种重要性质,下表给出8种元素的电负性数值:
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 | 0.8 |
①估计钙元素的电负性的取值范围:
0.8
0.8
<X<1.2
1.2
②经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于17时,所形成的一般为离子键;当小于1.7时,一般为共价键.试推断AlC13中形成的化学键的类型及其理由是
共价键,因为AlCl3中氯与铝的电负性差值为1.5小于1.7,故AlCl3中化学键为共价键
共价键,因为AlCl3中氯与铝的电负性差值为1.5小于1.7,故AlCl3中化学键为共价键
.[化学-物质结构与性质]
研究物质结构是为更好的掌握物质的性质.
(1)第四周期过渡元素在性质上存在一些特殊性,在前沿科技中应用广泛.
①铜为第四周期过渡元素,其基态原子电子排布式为
②金属镍粉在CO气流中轻微加热,生成液态Ni(CO)4分子.423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉.试推测Ni(CO)4易溶于下列
a.水 b.四氯化碳 c.苯 d.硫酸镍溶液
③在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4晶体,晶体中含有的化学键除普通共价键外,还有
(2)已知:下表是14种元素的电负性的数值(用X表示).
①经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键,如NaCl;当小于1.7时,一般为共价键,如AlCl3.请写出铁元素和表中非金属元素形成的常见共价化合物:
②气态氯化铝通常以二聚分子形式存在,分子式为Al2Cl6,分子中所有原子均达到8电子稳定结构,则Al2Cl6的结构式为
 .
.
③由表中两种元素形成的化合物中,分子中既含有σ键又含有π键,且二者数目相同的有(写一个即可)
查看习题详情和答案>>
研究物质结构是为更好的掌握物质的性质.
(1)第四周期过渡元素在性质上存在一些特殊性,在前沿科技中应用广泛.
①铜为第四周期过渡元素,其基态原子电子排布式为
[Ar]3d104s1
[Ar]3d104s1
,请解释金属铜能导电的原因铜是由自由电子和金属阳离子通过金属键形成,自由电子在外电场中可以定向移动,所以能导电.
铜是由自由电子和金属阳离子通过金属键形成,自由电子在外电场中可以定向移动,所以能导电.
.②金属镍粉在CO气流中轻微加热,生成液态Ni(CO)4分子.423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉.试推测Ni(CO)4易溶于下列
bc
bc
.a.水 b.四氯化碳 c.苯 d.硫酸镍溶液
③在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4晶体,晶体中含有的化学键除普通共价键外,还有
离子键、配位键
离子键、配位键
.(2)已知:下表是14种元素的电负性的数值(用X表示).
| 元素 | Al | B | Be | C | Cl | F | Li |
| X | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | Na | O | P | S | Si | Fe |
| X | 1.2 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 | 1.8 |
FeCl3或FeS
FeCl3或FeS
.②气态氯化铝通常以二聚分子形式存在,分子式为Al2Cl6,分子中所有原子均达到8电子稳定结构,则Al2Cl6的结构式为


③由表中两种元素形成的化合物中,分子中既含有σ键又含有π键,且二者数目相同的有(写一个即可)
CO2或CS2
CO2或CS2
,其分子空间构型为直线型
直线型
.