摘要:Na Al S C
网址:http://m.1010jiajiao.com/timu3_id_358661[举报]
下列有关说法正确的是( )
| A、第三周期元素第一电离能:Na<Mg<Al<Si<P<S<Cl | B、第三周期元素所形成的简单离子半径大小:Na+>Mg2+>Al3+>P3->S2->Cl- | C、电负性不等的两种元素所形成的化合物分子一定是极性分子 | D、无机含氧酸的强度随着分子中连接在中心原子上的非羟基氧的个数增大而增大 |
(1)有下列七种物质:A.干冰 B.氧化镁 C.氯化铵 D.固态碘 E.烧碱 F.冰 G.过氧化钾
①熔化时需要破坏共价键和离子键的是
②熔点最低的是
④只含有极性键的是
⑥以分子形式存在的是:
(2)依下列条件回答下列问题①A、B、C三种元素原子序数依次为a、b、c,它们对应离子具有相同的电子层结构An+、Bn-、Cm-,且n>m,则原子序数由小至大的顺序为:
②元素A中子数为a,简单离子核外共有x个电子,带+n个电荷,则该微粒可表示为:

③X、Y、Z三种短周期元素,原子序数依次增大,它们的最高价氧化物对应水化物两两能发生反应,则X、Y、Z元素符号依次是:
④R元素的最高价氧化物对应水化物的化学式为HnROn,则它对应的气态氢化物的化学式为:
查看习题详情和答案>>
①熔化时需要破坏共价键和离子键的是
C
C
(填序号,下同);②熔点最低的是
A
A
;③既有离子键又有共价键的是CEG
CEG
;④只含有极性键的是
AF
AF
;⑤含非极性键的是DG
DG
.⑥以分子形式存在的是:
ADF
ADF
(2)依下列条件回答下列问题①A、B、C三种元素原子序数依次为a、b、c,它们对应离子具有相同的电子层结构An+、Bn-、Cm-,且n>m,则原子序数由小至大的顺序为:
b<a<c
b<a<c
②元素A中子数为a,简单离子核外共有x个电子,带+n个电荷,则该微粒可表示为:


③X、Y、Z三种短周期元素,原子序数依次增大,它们的最高价氧化物对应水化物两两能发生反应,则X、Y、Z元素符号依次是:
N、Na、Al或Na、Al、S或Na、Al、Cl
N、Na、Al或Na、Al、S或Na、Al、Cl
.④R元素的最高价氧化物对应水化物的化学式为HnROn,则它对应的气态氢化物的化学式为:
H(8-n)R或RH(8-n)
H(8-n)R或RH(8-n)
.(2011?扬州三模)(1)在短周期主族元素中,氯及其相邻两元素的电负性由大到小的顺序是
(2)A、B、C为同一短周期金属元素.依据下表数据分析,C元素在化合物中的主要化合价为
(3)已知过氧化氢分子的空间结构如右图所示,分子中氧原子采取
通常情况下,H2O2与水任意比互溶的主要原因是
(4)R是1~36号元素中未成对电子数最多的原子.R3+在溶液中存在如下转化:R3+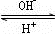 R(OH)3
R(OH)3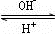 [R(OH)4]-
[R(OH)4]-
①基态R原子的价电子排布式为
A.离子键 B.极性键 C.非极性键 D.配位键
(5)等电子体原理可广义理解为:重原子数相等(重原子指原子序数≥4),总电子数或价电子数相等的分子或离子.若将H2O2滴入液氨中,可得白色固体A,红外光谱显示,A中有阴阳两种离子,阳离子是正四面体,阴离子与H2O2互为等电子体.则A的结构简式为
查看习题详情和答案>>
F>Cl>S
F>Cl>S
(用元素符号表示)(2)A、B、C为同一短周期金属元素.依据下表数据分析,C元素在化合物中的主要化合价为
+3
+3
;A、B、C三种元素的原子半径由大到小的顺序是Na>Mg>Al
Na>Mg>Al
.| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 500 | 4600 | 6900 | 9500 |
| B | 740 | 1500 | 7700 | 10500 |
| C | 580 | 1800 | 2700 | 11600 |
sp3
sp3
杂化;通常情况下,H2O2与水任意比互溶的主要原因是
H2O2分子H2O分子之间形成氢键,使H2O2与水任意比互溶
H2O2分子H2O分子之间形成氢键,使H2O2与水任意比互溶
.(4)R是1~36号元素中未成对电子数最多的原子.R3+在溶液中存在如下转化:R3+
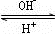 R(OH)3
R(OH)3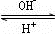 [R(OH)4]-
[R(OH)4]-①基态R原子的价电子排布式为
3d54s1
3d54s1
.②[R(OH)4]-中存在的化学键是BD
BD
.A.离子键 B.极性键 C.非极性键 D.配位键
(5)等电子体原理可广义理解为:重原子数相等(重原子指原子序数≥4),总电子数或价电子数相等的分子或离子.若将H2O2滴入液氨中,可得白色固体A,红外光谱显示,A中有阴阳两种离子,阳离子是正四面体,阴离子与H2O2互为等电子体.则A的结构简式为
NH4OOH
NH4OOH
.一定温度范围内用氯化钠熔浸钾长石(主要成份为KAlSi3O8)可制得氯化钾,主要反应是:
NaCl(l)+KAlSi3O8(s)?KCl(l)+NaAlSi3O8(s).
(1)上述反应涉及的第三周期元素中,离子半径最小的是 (用元素符号表示).Cl原子与Si原子可以形成的五核分子,其化学键长和键角都相等,则该物质为 分子(填“极性”或“非极性”).
(2)表示原子或离子结构的化学用语有:原子结构示意图、核外电子排布式、轨道表示式.从中选择最详尽描述核外电子运动状态的方式,来表示氧离子核外电子的运动状态: .
(3)上述元素的最高价氧化物对应水化物中,既能与强酸又能与强碱反应,其原因在于: (用电离方程式表示).
(4)Al与Cl可以形成分子晶体AlCl3,关于AlCl3溶液的说法错误的是 .
A.水溶液中离子浓度大小:c(Cl-)>c(Al3+)>c(H+)>c(OH-)
B.升高温度,AlCl3水溶液pH减小,c(Al3+)减小
C.c(Al3+)+c(H+)=c(Cl-)+c(OH-)
D.c(Cl-)=3c(Al3+)+3c(AlO2-)
(5)不能用于比较Na与Al金属性相对强弱的事实是 .
A.最高价氧化物对应水化物的碱性 B.Na和AlCl3溶液反应
C.单质与H2O反应的难易程度 D.比较同浓度NaCl和AlCl3的pH值
(6)Na和O2反应形成Na2O和Na2O2的混合物,阴阳离子的个数比为 .用电子式表示Na2O2的形成过程: .
查看习题详情和答案>>
NaCl(l)+KAlSi3O8(s)?KCl(l)+NaAlSi3O8(s).
(1)上述反应涉及的第三周期元素中,离子半径最小的是
(2)表示原子或离子结构的化学用语有:原子结构示意图、核外电子排布式、轨道表示式.从中选择最详尽描述核外电子运动状态的方式,来表示氧离子核外电子的运动状态:
(3)上述元素的最高价氧化物对应水化物中,既能与强酸又能与强碱反应,其原因在于:
(4)Al与Cl可以形成分子晶体AlCl3,关于AlCl3溶液的说法错误的是
A.水溶液中离子浓度大小:c(Cl-)>c(Al3+)>c(H+)>c(OH-)
B.升高温度,AlCl3水溶液pH减小,c(Al3+)减小
C.c(Al3+)+c(H+)=c(Cl-)+c(OH-)
D.c(Cl-)=3c(Al3+)+3c(AlO2-)
(5)不能用于比较Na与Al金属性相对强弱的事实是
A.最高价氧化物对应水化物的碱性 B.Na和AlCl3溶液反应
C.单质与H2O反应的难易程度 D.比较同浓度NaCl和AlCl3的pH值
(6)Na和O2反应形成Na2O和Na2O2的混合物,阴阳离子的个数比为
s国钾长石(KAlSi3O8)的资源比较丰富.一定温度范围内用氯化钠熔浸钾长石(主要成份为KAlSi3O8)可制得氯化钾,主要反应是:NaCl(l)+KAlSi3O8(s)?KCl(l)+NaAlSi3O8(s).
(1)1述反应涉及的第三周期元素中,离子半径最小的是______(用元素符号表示).Cl原子与Si原子可以形成的五核分子,其化学键键长和键角都相等,则该物质为______分子(填“极性”或“非极性”),该分子的电子式为______.
(2)不能用于比较Na与Al金属性相对强弱的事实是______.
A.最高价氧化物对应水化物的碱性B.Na和Al的熔点高低
C.单质与H2O反应的难易程度D.比较同浓度NaCl和AlCl3的pH值
(3)1述元素的最高价氧化物对应水化物中,有一种既能与强酸又能与强碱反应,其原因在于:______(用电离方程式表示).
(4)钾长石和烧碱在熔融状态下反应可得到两种正盐,向所得的正盐中加入过量稀盐酸,发生反应的离子方程式分别是:______、______.
(5)制取粗硅的过程中,SiO是反应中间产物,隔绝空气时SiO和NaOH溶液反应(产物之一是硅酸钠)的化学方程式______.
(6)为研究1述反应中钾元素的熔出率(液体中钾元素的质量占全部钾元素质量的百分率)与温度的关系,进行实验(氯化钠与钾长石投料的质量比为2:1),获得如下数据:
①分析数据可以得出,该制备氯化钾的反应是______(填“放热”或“吸热”)反应.
②计算890℃时,氯化钠的平衡转化率______(式量:KAlSi3O8-278NaAlSi3O8-262,保留3位小数).
查看习题详情和答案>>
(1)1述反应涉及的第三周期元素中,离子半径最小的是______(用元素符号表示).Cl原子与Si原子可以形成的五核分子,其化学键键长和键角都相等,则该物质为______分子(填“极性”或“非极性”),该分子的电子式为______.
(2)不能用于比较Na与Al金属性相对强弱的事实是______.
A.最高价氧化物对应水化物的碱性B.Na和Al的熔点高低
C.单质与H2O反应的难易程度D.比较同浓度NaCl和AlCl3的pH值
(3)1述元素的最高价氧化物对应水化物中,有一种既能与强酸又能与强碱反应,其原因在于:______(用电离方程式表示).
(4)钾长石和烧碱在熔融状态下反应可得到两种正盐,向所得的正盐中加入过量稀盐酸,发生反应的离子方程式分别是:______、______.
(5)制取粗硅的过程中,SiO是反应中间产物,隔绝空气时SiO和NaOH溶液反应(产物之一是硅酸钠)的化学方程式______.
(6)为研究1述反应中钾元素的熔出率(液体中钾元素的质量占全部钾元素质量的百分率)与温度的关系,进行实验(氯化钠与钾长石投料的质量比为2:1),获得如下数据:
时间(h) 钾元素 温度熔出率 | 1.5 | 2.5 | 3.0 | 3.5 | 4.0 |
| 830℃ | 0.481 | 0.575 | 0.626 | 0.669 | 0.685 |
| 890℃ | 0.579 | 0.691 | 0.694 | 0.699 | 0.699 |
| 950℃ | 0.669 | 0.714 | 0.714 | 0.714 | 0.714 |
②计算890℃时,氯化钠的平衡转化率______(式量:KAlSi3O8-278NaAlSi3O8-262,保留3位小数).