题目内容
下列有关说法正确的是( )
| A、第三周期元素第一电离能:Na<Mg<Al<Si<P<S<Cl | B、第三周期元素所形成的简单离子半径大小:Na+>Mg2+>Al3+>P3->S2->Cl- | C、电负性不等的两种元素所形成的化合物分子一定是极性分子 | D、无机含氧酸的强度随着分子中连接在中心原子上的非羟基氧的个数增大而增大 |
分析:A.P原子最外层3p能级电子为半充满,较稳定;
B.根据离子核外电子层数的多少以及核电荷数判断;
C.电负性不等的两种元素所形成的化合物如为多原子分子,可能为非极性分子;
D.无机含氧酸的强度随着分子中连接在中心原子上的非羟基氧的个数越多,分子中的O-H越易断裂,酸性越强.
B.根据离子核外电子层数的多少以及核电荷数判断;
C.电负性不等的两种元素所形成的化合物如为多原子分子,可能为非极性分子;
D.无机含氧酸的强度随着分子中连接在中心原子上的非羟基氧的个数越多,分子中的O-H越易断裂,酸性越强.
解答:解:A.P原子最外层3p能级电子为半充满,较稳定,第一电离能应为S<P,故A错误;
B.Na+、Mg2+、Al3+具有相同的核外电子排布,核电荷数越多,离子半径越小,则为Na+>Mg2+>Al3+,但小于同周期阴离子的离子半径,应为P3->S2->Cl->Na+>Mg2+>Al3+,故B错误;
C.电负性不等的两种元素所形成的化合物如为多原子分子,可能为非极性分子,如CCl4等,故C错误;
D.无机含氧酸的强度随着分子中连接在中心原子上的非羟基氧的个数越多,分子中的O-H越易断裂,酸性越强,故D正确.
故选D.
B.Na+、Mg2+、Al3+具有相同的核外电子排布,核电荷数越多,离子半径越小,则为Na+>Mg2+>Al3+,但小于同周期阴离子的离子半径,应为P3->S2->Cl->Na+>Mg2+>Al3+,故B错误;
C.电负性不等的两种元素所形成的化合物如为多原子分子,可能为非极性分子,如CCl4等,故C错误;
D.无机含氧酸的强度随着分子中连接在中心原子上的非羟基氧的个数越多,分子中的O-H越易断裂,酸性越强,故D正确.
故选D.
点评:本题考查元素周期律知识,涉及电子排布、原子结构、酸性比较等知识,为高考高频考点,侧重于学生分析能力的考查,注意把握元素周期律的递变规律以及元素的性质与对应单质、化合物的性质的关系,难度不大.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
 (2012?绵阳模拟)钾在氧气中燃烧时得到一种钾的氧化物晶体,其结构如图所示,下列有关说法正确的是( )
(2012?绵阳模拟)钾在氧气中燃烧时得到一种钾的氧化物晶体,其结构如图所示,下列有关说法正确的是( )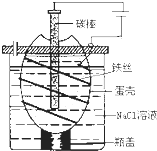 工业上通过电解饱和氯化钠溶液的方法获得氢氧化钠和氯气,图为某实验小组自制的电解饱和食盐水的简易装置,
工业上通过电解饱和氯化钠溶液的方法获得氢氧化钠和氯气,图为某实验小组自制的电解饱和食盐水的简易装置, (2009?上海)海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等.
(2009?上海)海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等.