摘要:为提高SO2的转化率.通常使用过量的空气.使SO2充分氧化.故从接触室出来的混合气体含有 A.SO3.O2 B.SO3.O2.N2 C.SO3.N2 D.SO3.SO2.O2.N2
网址:http://m.1010jiajiao.com/timu3_id_358640[举报]
(8分)硫酸生产中,SO2催化氧化成SO3的热化学方程式为:
2 SO2 (g)+ O2(g) 2 SO3(g) △H =" —196.0" kJ.mol-1
2 SO3(g) △H =" —196.0" kJ.mol-1
①容器体积不变时,为了提高SO2的转化率,可采用的措施是_____(填字母标号)。(2分)
| A.加入V2O5做催化剂 | B. 使用过量SO2 使用过量SO2 | C.高温 | D.通入过量空气 |
(8分)硫酸生产中,SO2催化氧化成SO3的热化学方程式为:
2 SO2 (g)+ O2(g) 2 SO3(g) △H =" —196.0" kJ.mol-1
2 SO3(g) △H =" —196.0" kJ.mol-1
①容器体积不变时,为了提高SO2的转化率,可采用的措施是_____(填字母标号)。(2分)
②某温度时,在一个容积为10L的密闭容器中充入4.0mol SO2和2.0molO2,半分钟后达到平衡,并放出352.8 kJ的热量。此时SO2的转化率是_____,该温度下的平衡常数K===_____________。(每空3分)
2 SO2 (g)+ O2(g)
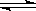 2 SO3(g) △H =" —196.0" kJ.mol-1
2 SO3(g) △H =" —196.0" kJ.mol-1①容器体积不变时,为了提高SO2的转化率,可采用的措施是_____(填字母标号)。(2分)
| A.加入V2O5做催化剂 | B. 使用过量SO2 使用过量SO2 | C.高温 | D.通入过量空气 |
工业上以黄铁矿为原料生产硫酸,其中重要的一步是催化氧化:
2SO2(g)+O2(g)?2SO3(g),△H=-196.6kJ?mol-1
(1)生产中为提高反应速率和SO2的转化率,下列措施可行的是 (填字母).
A.向装置中充入N2
B.向装置中充入过量的O2
C.使用更高效的催化剂
D.升高温度
(2)在一密闭容器中充入4mol SO2和一定量O2,当放出353.6kJ热量时,SO2的转化率最接近于 (填字母).
A.40% B.50% C.80% D.90%
(3)580℃时,在一密闭容器中充入一定量的SO2和O2,当反应达到平衡后测得SO2、O2和SO3的浓度分别为6.0×10-3mol?L-1、8.0×10-3mol?L-1和4.4×10-2mol?L-1.该温度下反应2SO2(g)+O2(g)?2SO3(g)的平衡常数K= .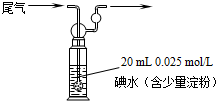
(4)硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时需要加以处理后才能排放.现用右图所示装置测定尾气中SO2的含量,当通入尾气11.2L(标准状况下测定)时,碘水恰好褪色.通过计算说明,该尾气能否直接排放(写出计算过程). .
查看习题详情和答案>>
2SO2(g)+O2(g)?2SO3(g),△H=-196.6kJ?mol-1
(1)生产中为提高反应速率和SO2的转化率,下列措施可行的是
A.向装置中充入N2
B.向装置中充入过量的O2
C.使用更高效的催化剂
D.升高温度
(2)在一密闭容器中充入4mol SO2和一定量O2,当放出353.6kJ热量时,SO2的转化率最接近于
A.40% B.50% C.80% D.90%
(3)580℃时,在一密闭容器中充入一定量的SO2和O2,当反应达到平衡后测得SO2、O2和SO3的浓度分别为6.0×10-3mol?L-1、8.0×10-3mol?L-1和4.4×10-2mol?L-1.该温度下反应2SO2(g)+O2(g)?2SO3(g)的平衡常数K=

(4)硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时需要加以处理后才能排放.现用右图所示装置测定尾气中SO2的含量,当通入尾气11.2L(标准状况下测定)时,碘水恰好褪色.通过计算说明,该尾气能否直接排放(写出计算过程).
工业上以黄铁矿为原料生产硫酸,其中重要的一步是催化氧化(生产中保持恒温恒容条件):2SO2(g)+O2 (g) 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
⑴生产中为提高反应速率和SO2的转化率,下列措施可行的是_______(填字母,下同)。
A.向装置中充入N2
B.向装置中充入过量的SO2
C.向装置中充入O2
D.升高温度
⑵若在一定温度下,向一个容积可变的恒压容器中,通入3mol SO2 和2mol O2 及固体催化剂,发生上述反应,平衡时容器内气体体积为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为 5mol SO2(g)、3.5 mol O2(g)、1mol SO3(g) ,下列说法正确的是___________
A.第一次平衡时反应放出的热量为294.9kJ
B.两次平衡SO2的转化率相等
C.两次平衡时的O2体积分数相等
D.第二次平衡时SO3的体积分数等于2/9
⑶生产中在550 ℃时,将2.0 mol SO2和1.0 mol O2置于 5 L密闭容器中,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图所示。反应达平衡后,体系总压强为
0.10 M Pa。试计算反应 2SO3 2SO2+O2 在550 ℃时的平衡常数K=_________。 A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是:__________________,并比较不同压强下的平衡常数:K(0.10 MPa) _________K(1.0 MPa)(填 “<”或“>”或“=”)。
2SO2+O2 在550 ℃时的平衡常数K=_________。 A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是:__________________,并比较不同压强下的平衡常数:K(0.10 MPa) _________K(1.0 MPa)(填 “<”或“>”或“=”)。
 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1⑴生产中为提高反应速率和SO2的转化率,下列措施可行的是_______(填字母,下同)。
A.向装置中充入N2
B.向装置中充入过量的SO2
C.向装置中充入O2
D.升高温度
⑵若在一定温度下,向一个容积可变的恒压容器中,通入3mol SO2 和2mol O2 及固体催化剂,发生上述反应,平衡时容器内气体体积为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为 5mol SO2(g)、3.5 mol O2(g)、1mol SO3(g) ,下列说法正确的是___________
A.第一次平衡时反应放出的热量为294.9kJ
B.两次平衡SO2的转化率相等
C.两次平衡时的O2体积分数相等
D.第二次平衡时SO3的体积分数等于2/9
⑶生产中在550 ℃时,将2.0 mol SO2和1.0 mol O2置于 5 L密闭容器中,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图所示。反应达平衡后,体系总压强为
0.10 M Pa。试计算反应 2SO3
 2SO2+O2 在550 ℃时的平衡常数K=_________。 A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是:__________________,并比较不同压强下的平衡常数:K(0.10 MPa) _________K(1.0 MPa)(填 “<”或“>”或“=”)。
2SO2+O2 在550 ℃时的平衡常数K=_________。 A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是:__________________,并比较不同压强下的平衡常数:K(0.10 MPa) _________K(1.0 MPa)(填 “<”或“>”或“=”)。 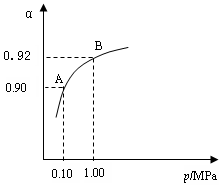
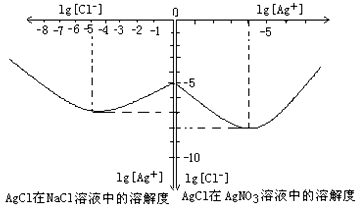
⑷沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变。已知AgCl + Cl- =[AgCl2]-,下图是某温度下AgCl在NaCl溶液中的溶解情况。由以上信息可知:
①由图知该温度下AgCl的溶度积常数为__________________________。
②AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:__________________________
①由图知该温度下AgCl的溶度积常数为__________________________。
②AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:__________________________
工业上以黄铁矿为原料生产硫酸,其中重要的一步是催化氧化(生产中保持恒温恒容条件):2SO2(g)+O2 (g) 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
⑴生产中为提高反应速率和SO2的转化率,下列措施可行的是_______(填字母,下同)。
A.向装置中充入N2
B.向装置中充入过量的SO2
C.向装置中充入O2
D.升高温度
⑵若在一定温度下,向一个容积可变的恒压容器中,通入3mol SO2 和2mol O2 及固体催化剂,发生上述反应,平衡时容器内气体体积为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为 5mol SO2(g)、3.5 mol O2(g)、1mol SO3(g) ,下列说法正确的是___________
A.第一次平衡时反应放出的热量为294.9kJ
B.两次平衡SO2的转化率相等
C.两次平衡时的O2体积分数相等
D.第二次平衡时SO3的体积分数等于2/9
⑶生产中在550 ℃时,将2.0 mol SO2和1.0 mol O2置于 5 L密闭容器中,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图所示。反应达平衡后,体系总压强为
0.10 M Pa。试计算反应 2SO3 2SO2+O2 在550 ℃时的平衡常数K=_________。 A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是:__________________,并比较不同压强下的平衡常数:K(0.10 MPa) _________K(1.0 MPa)(填 “<”或“>”或“=”)。
2SO2+O2 在550 ℃时的平衡常数K=_________。 A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是:__________________,并比较不同压强下的平衡常数:K(0.10 MPa) _________K(1.0 MPa)(填 “<”或“>”或“=”)。
 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1⑴生产中为提高反应速率和SO2的转化率,下列措施可行的是_______(填字母,下同)。
A.向装置中充入N2
B.向装置中充入过量的SO2
C.向装置中充入O2
D.升高温度
⑵若在一定温度下,向一个容积可变的恒压容器中,通入3mol SO2 和2mol O2 及固体催化剂,发生上述反应,平衡时容器内气体体积为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为 5mol SO2(g)、3.5 mol O2(g)、1mol SO3(g) ,下列说法正确的是___________
A.第一次平衡时反应放出的热量为294.9kJ
B.两次平衡SO2的转化率相等
C.两次平衡时的O2体积分数相等
D.第二次平衡时SO3的体积分数等于2/9
⑶生产中在550 ℃时,将2.0 mol SO2和1.0 mol O2置于 5 L密闭容器中,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图所示。反应达平衡后,体系总压强为
0.10 M Pa。试计算反应 2SO3
 2SO2+O2 在550 ℃时的平衡常数K=_________。 A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是:__________________,并比较不同压强下的平衡常数:K(0.10 MPa) _________K(1.0 MPa)(填 “<”或“>”或“=”)。
2SO2+O2 在550 ℃时的平衡常数K=_________。 A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是:__________________,并比较不同压强下的平衡常数:K(0.10 MPa) _________K(1.0 MPa)(填 “<”或“>”或“=”)。 
⑷沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变。已知AgCl + Cl- =[AgCl2]-,下图是某温度下AgCl在NaCl溶液中的溶解情况。由以上信息可知:
①由图知该温度下AgCl的溶度积常数为__________________________。
②AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:__________________________
①由图知该温度下AgCl的溶度积常数为__________________________。
②AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:__________________________
