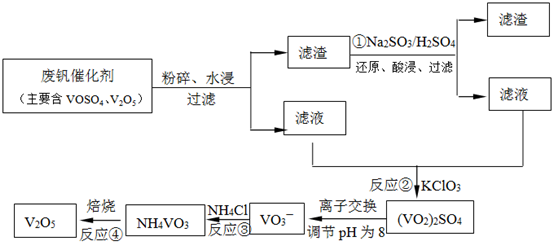
题目内容
工业上以黄铁矿为原料生产硫酸,其中重要的一步是催化氧化:
2SO2(g)+O2(g)?2SO3(g),△H=-196.6kJ?mol-1
(1)生产中为提高反应速率和SO2的转化率,下列措施可行的是 (填字母).
A.向装置中充入N2
B.向装置中充入过量的O2
C.使用更高效的催化剂
D.升高温度
(2)在一密闭容器中充入4mol SO2和一定量O2,当放出353.6kJ热量时,SO2的转化率最接近于 (填字母).
A.40% B.50% C.80% D.90%
(3)580℃时,在一密闭容器中充入一定量的SO2和O2,当反应达到平衡后测得SO2、O2和SO3的浓度分别为6.0×10-3mol?L-1、8.0×10-3mol?L-1和4.4×10-2mol?L-1.该温度下反应2SO2(g)+O2(g)?2SO3(g)的平衡常数K= .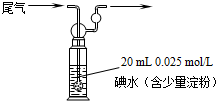
(4)硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时需要加以处理后才能排放.现用右图所示装置测定尾气中SO2的含量,当通入尾气11.2L(标准状况下测定)时,碘水恰好褪色.通过计算说明,该尾气能否直接排放(写出计算过程). .
2SO2(g)+O2(g)?2SO3(g),△H=-196.6kJ?mol-1
(1)生产中为提高反应速率和SO2的转化率,下列措施可行的是
A.向装置中充入N2
B.向装置中充入过量的O2
C.使用更高效的催化剂
D.升高温度
(2)在一密闭容器中充入4mol SO2和一定量O2,当放出353.6kJ热量时,SO2的转化率最接近于
A.40% B.50% C.80% D.90%
(3)580℃时,在一密闭容器中充入一定量的SO2和O2,当反应达到平衡后测得SO2、O2和SO3的浓度分别为6.0×10-3mol?L-1、8.0×10-3mol?L-1和4.4×10-2mol?L-1.该温度下反应2SO2(g)+O2(g)?2SO3(g)的平衡常数K=

(4)硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时需要加以处理后才能排放.现用右图所示装置测定尾气中SO2的含量,当通入尾气11.2L(标准状况下测定)时,碘水恰好褪色.通过计算说明,该尾气能否直接排放(写出计算过程).
分析:(1)该反应是一个反应前后气体体积减小的放热反应,欲提高SO2的转化率,则改变条件使平衡向正反应方向移动;
(2)由2SO2(g)+O2(g)?2SO3(g),△H=-196.6kJ?mol-1,则1mol SO2完全反应,放出98.2kJ的热量,利用物质的量与放出的热量成正比计算反应的二氧化硫,以此计算SO2的转化率;
(3)根据化学平衡常数=
来计算化学平衡常数;
(4)计算二氧化硫的含量,根据硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时不能任意排放来回答.
(2)由2SO2(g)+O2(g)?2SO3(g),△H=-196.6kJ?mol-1,则1mol SO2完全反应,放出98.2kJ的热量,利用物质的量与放出的热量成正比计算反应的二氧化硫,以此计算SO2的转化率;
(3)根据化学平衡常数=
| 生成物平衡浓度系数次幂之积 |
| 反应物平衡浓度系数次幂之积 |
(4)计算二氧化硫的含量,根据硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时不能任意排放来回答.
解答:解:(1)A.向装置中充入N2,化学平衡不会移动,不会提高二氧化硫转化率,故A错误;
B.向装置中充入过量的O2,化学平衡正向移动,会提高二氧化硫转化率,故B正确;
C.使用更高效的催化剂,不会引起化学平衡的移动,不会提高二氧化硫转化率,故C错误;
D.升高温度,化学平衡逆向移动,二氧化硫的转化率减小,故D错误.
故选:B.
(2)设反应的二氧化硫为x,则
2SO2(g)+O2(g)?2SO3(g),△H=-196.6kJ?mol-1
2mol 196.6kJ
x 353.6kJ
=
,解得x=3.6mol,
所以SO2的转化率为
×100%=90%,
故选:D.
(3)反应达到平衡后测得SO2、O2和SO3的浓度分别为6.0×10-3mol?L-1、8.0×10-3mol?L-1和4.4×10-2mol?L-1.该温度下反应2SO2(g)+O2(g)?2SO3(g)的平衡常数K=
=
=6.72×103,
故答案为:6.72×103;
(4)根据反应SO2+I2+2H2O═H2SO4+2HI,n(SO2)=n(I2)=20×10-3 L×0.025 mol/L=0.0005 mol,V(SO2)=0.0005 mol×22.4 L/mol=0.0112 L
V(SO2)%=
×100%=0.1%>0.05%,故不能直接排放,
故答案为:反应中SO2+I2+2H2O═H2SO4+2HI,n(SO2)=n(I2)=20×10-3 L×0.025 mol/L=0.0005 mol,V(SO2)=0.0005 mol×22.4 L/mol=0.0112 L,V(SO2)%=
×100%=0.1%>0.05%,故不能直接排放.
B.向装置中充入过量的O2,化学平衡正向移动,会提高二氧化硫转化率,故B正确;
C.使用更高效的催化剂,不会引起化学平衡的移动,不会提高二氧化硫转化率,故C错误;
D.升高温度,化学平衡逆向移动,二氧化硫的转化率减小,故D错误.
故选:B.
(2)设反应的二氧化硫为x,则
2SO2(g)+O2(g)?2SO3(g),△H=-196.6kJ?mol-1
2mol 196.6kJ
x 353.6kJ
| 2 |
| x |
| 196.6 |
| 353.6 |
所以SO2的转化率为
| 3.6 |
| 4 |
故选:D.
(3)反应达到平衡后测得SO2、O2和SO3的浓度分别为6.0×10-3mol?L-1、8.0×10-3mol?L-1和4.4×10-2mol?L-1.该温度下反应2SO2(g)+O2(g)?2SO3(g)的平衡常数K=
| c2(SO3) |
| c2(SO2)?c(O2) |
| (4.4×10-2)2 |
| (8.0×10-3)?(6.0×10-3)2 |
故答案为:6.72×103;
(4)根据反应SO2+I2+2H2O═H2SO4+2HI,n(SO2)=n(I2)=20×10-3 L×0.025 mol/L=0.0005 mol,V(SO2)=0.0005 mol×22.4 L/mol=0.0112 L
V(SO2)%=
| 0.0112L |
| 11.2L |
故答案为:反应中SO2+I2+2H2O═H2SO4+2HI,n(SO2)=n(I2)=20×10-3 L×0.025 mol/L=0.0005 mol,V(SO2)=0.0005 mol×22.4 L/mol=0.0112 L,V(SO2)%=
| 0.0112L |
| 11.2L |
点评:本题涉及化学平衡的影响因素以及平衡的计算等知识,主要知识的归纳和整理是解题的关键,难度不大.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目

 工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收.请回答下列个问题:
工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收.请回答下列个问题: