摘要:某盐Na2R2O3·5H2O遇酸分解.具有还原性.R2O的结构如图所示.其中两个R处于不同的价态.则R①和R②的价态分别是 A.+3.-1 B.+6.-2 C.+4.-1 D.-3.+1
网址:http://m.1010jiajiao.com/timu3_id_358638[举报]
A、J是日常生活中常见的两种金属,这两种金属和NaOH组成原电池,A作负极;F常温下是气体,各物质有以下的转化关系(部分产物及条件略去).
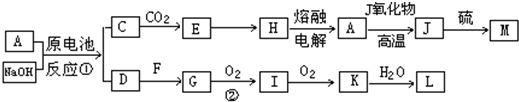
请回答以下问题:
(1)写出下列物质的化学式:M ;L .
(2)写出反应①的化学方程式 .
(3)常温时pH=12的C溶液中,溶质的阳离子与溶质的阴离子浓度之差为 (写出计算式);相同条件下,等浓度的C溶液与CH3COONa溶液中,C的阴离子与CH3COO-浓度的大小关系:前者 后者(用“>”、“<”或“=”表示).
(4)写出反应②的化学方程式 .
(5)含A元素的某盐X常做净水剂,其焰色反应透过蓝色钴玻璃观察为紫色,写出其水溶液与过量的氨水溶液反应的离子方程式为 .
查看习题详情和答案>>

请回答以下问题:
(1)写出下列物质的化学式:M
(2)写出反应①的化学方程式
(3)常温时pH=12的C溶液中,溶质的阳离子与溶质的阴离子浓度之差为
(4)写出反应②的化学方程式
(5)含A元素的某盐X常做净水剂,其焰色反应透过蓝色钴玻璃观察为紫色,写出其水溶液与过量的氨水溶液反应的离子方程式为
A、B、C、D、E 5种元素,A元素所处的周期数、主族序数、原子序数均相等;B是地壳中含量最多的元素;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成离子化合物D2C.E的单质既能与强酸反应,又能与强碱反应放出氢气.
(1)B在周期表中的位置:第
(2)C的气态氢化物的电子式
 .
.
(3)D的最高价氧化物的水化物与E单质反应的离子方程式
(4)写出由这五种元素形成的某盐晶体化学式
(5)在①A2B、②D2B、③DBA、④B2、⑤DACB4、⑥D2C这6种物质中,只含共价键的是
查看习题详情和答案>>
(1)B在周期表中的位置:第
二
二
周期,第ⅥA
ⅥA
族.(2)C的气态氢化物的电子式


(3)D的最高价氧化物的水化物与E单质反应的离子方程式
2Al+2OH-+2e-=2AlO2-+3H2↑
2Al+2OH-+2e-=2AlO2-+3H2↑
.(4)写出由这五种元素形成的某盐晶体化学式
KAl(SO4)2?12H2O
KAl(SO4)2?12H2O
,它在日常生活中的作用是净水剂
净水剂
.(5)在①A2B、②D2B、③DBA、④B2、⑤DACB4、⑥D2C这6种物质中,只含共价键的是
①④
①④
;只含离子键的是②⑥
②⑥
;既含共价键又含离子键的是③⑤
③⑤
(均填数字序号).(2012?宜春模拟)下列说法中正确的有( )
①由“HF比HCl稳定性好”,可推知HF比HCl沸点高
②锌与稀硫酸反应时,要加大反应速率可滴加少量硫酸铜
③蔗糖溶液、硫酸钡和水分别属于非电解质、强电解质和弱电解质
④由“某过程发生化学键断裂”,可推知该过程发生了化学变化
⑤常温下,将铝片放入浓硝酸中,无明显现象,说明铝不与冷的浓硝酸反应
⑥某盐的水溶液呈酸性,该盐不一定是强酸弱碱盐
⑦用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧,说明CO2、H2O与Na2O2反应是放热反应
⑧能与酸反应的氧化物,不一定是碱性氧化物.
①由“HF比HCl稳定性好”,可推知HF比HCl沸点高
②锌与稀硫酸反应时,要加大反应速率可滴加少量硫酸铜
③蔗糖溶液、硫酸钡和水分别属于非电解质、强电解质和弱电解质
④由“某过程发生化学键断裂”,可推知该过程发生了化学变化
⑤常温下,将铝片放入浓硝酸中,无明显现象,说明铝不与冷的浓硝酸反应
⑥某盐的水溶液呈酸性,该盐不一定是强酸弱碱盐
⑦用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧,说明CO2、H2O与Na2O2反应是放热反应
⑧能与酸反应的氧化物,不一定是碱性氧化物.
查看习题详情和答案>>
某盐的混合物中含有0.1mol Na+、0.6mol Mg2+、0.3mol Cl-,还有SO42-,则SO42-为( )
| A、0.1mol | B、0.5mol | C、0.3 mol | D、0.7mol |