摘要:用配平的化学方程式表示下述实验现象: ⑴铝酸钠溶液中加入氯化铵溶液.加热有乳白色沉淀产生.并放出一种刺激性气体 , ⑵在碘化钾和过量氯酸钾组成的混合溶液中滴入H2SO4.溶液的颜色逐步由无色转变为黄色.再转变为紫黑色.最后又变成无色. .
网址:http://m.1010jiajiao.com/timu3_id_358528[举报]
某校化学兴趣小组的同学用滴定法对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定.实验步骤如下,回答下列问题:
(1)用分析天平准确称取该样品5.000g,全部溶于水配制成1000.0mL的溶液.用
(2)用浓度为0.1000mol/L的盐酸标准溶液进行滴定.滴定管在使用前应先检漏、洗涤、
(3)若用测定溶液pH的方法来确定滴定的终点,则应用
(4)滴定过程中,锥形瓶中溶液的pH变化如下
请绘制出上述中和滴定的曲线.
(5)下表是几种酸碱指示剂的变色范围,根据你作出的中和滴定曲线分析,上述中和滴定中可选用的指示剂是
(6)样品中,NaOH的质量百分含量为
查看习题详情和答案>>
(1)用分析天平准确称取该样品5.000g,全部溶于水配制成1000.0mL的溶液.用
碱式滴定管
碱式滴定管
量取其中20.00mL放在锥形瓶中,滴加几滴指示剂,待测.(2)用浓度为0.1000mol/L的盐酸标准溶液进行滴定.滴定管在使用前应先检漏、洗涤、
用待装液润洗
用待装液润洗
、正式装液,排除气泡并调节液面.(3)若用测定溶液pH的方法来确定滴定的终点,则应用
pH计
pH计
测定锥形瓶中溶液的pH,临近滴定终点时应注意每滴一滴测一次
每滴一滴测一次
.(4)滴定过程中,锥形瓶中溶液的pH变化如下
| V(HCl)/mL | 0.00 | 12.00 | 18.00 | 22.00 | 23.00 | 23.96 | 24.00 | 24.04 | 25.00 | 26.00 | 30.00 |
| pH | 13.1 | 12.6 | 12.2 | 11.7 | 11.4 | 9.9 | 7.0 | 4.0 | 2.7 | 2.4 | 1.9 |
(5)下表是几种酸碱指示剂的变色范围,根据你作出的中和滴定曲线分析,上述中和滴定中可选用的指示剂是
甲基橙或酚酞
甲基橙或酚酞
,滴定终点的现象是溶液由黄色变成橙色其半分钟不褪色(或溶液由粉红色变为无色且半分钟不褪色)
溶液由黄色变成橙色其半分钟不褪色(或溶液由粉红色变为无色且半分钟不褪色)
.(如有几种,可任填一种)| 指示剂 | 变色范围 (pH) |
各范围内颜色 | ||
| 前 | 中间 | 后 | ||
| 甲基橙 | 3.1~4.4 | 红 | 橙色 | 黄 |
| 石蕊 | 5.0~8.0 | 红 | 紫色 | 蓝 |
| 酚酞 | 8.2~10.0 | 无 | 粉红 | 红 |
96%
96%
.若滴定前滴定管尖嘴部分有气泡,滴定终了没有气泡,则会造成计算值偏大
偏大
(填“偏大”、“偏小”或“无法确定”).某校化学兴趣小组的同学用滴定法对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定.实验步骤如下,回答下列问题:
(1)用分析天平准确称取该样品5.000g,全部溶于水配制成1000.0mL的溶液.用______量取其中20.00mL放在锥形瓶中,滴加几滴指示剂,待测.
(2)用浓度为0.1000mol/L的盐酸标准溶液进行滴定.滴定管在使用前应先检漏、洗涤、______、正式装液,排除气泡并调节液面.
(3)若用测定溶液pH的方法来确定滴定的终点,则应用______测定锥形瓶中溶液的pH,临近滴定终点时应注意______.
(4)滴定过程中,锥形瓶中溶液的pH变化如下
请绘制出上述中和滴定的曲线.
(5)下表是几种酸碱指示剂的变色范围,根据你作出的中和滴定曲线分析,上述中和滴定中可选用的指示剂是______,滴定终点的现象是______.(如有几种,可任填一种)
(6)样品中,NaOH的质量百分含量为______.若滴定前滴定管尖嘴部分有气泡,滴定终了没有气泡,则会造成计算值______(填“偏大”、“偏小”或“无法确定”).
查看习题详情和答案>>
(1)用分析天平准确称取该样品5.000g,全部溶于水配制成1000.0mL的溶液.用______量取其中20.00mL放在锥形瓶中,滴加几滴指示剂,待测.
(2)用浓度为0.1000mol/L的盐酸标准溶液进行滴定.滴定管在使用前应先检漏、洗涤、______、正式装液,排除气泡并调节液面.
(3)若用测定溶液pH的方法来确定滴定的终点,则应用______测定锥形瓶中溶液的pH,临近滴定终点时应注意______.
(4)滴定过程中,锥形瓶中溶液的pH变化如下
| V(HCl)/mL | 0.00 | 12.00 | 18.00 | 22.00 | 23.00 | 23.96 | 24.00 | 24.04 | 25.00 | 26.00 | 30.00 |
| pH | 13.1 | 12.6 | 12.2 | 11.7 | 11.4 | 9.9 | 7.0 | 4.0 | 2.7 | 2.4 | 1.9 |
(5)下表是几种酸碱指示剂的变色范围,根据你作出的中和滴定曲线分析,上述中和滴定中可选用的指示剂是______,滴定终点的现象是______.(如有几种,可任填一种)
| 指示剂 | 变色范围 (pH) | 各范围内颜色 | ||
| 前 | 中间 | 后 | ||
| 甲基橙 | 3.1~4.4 | 红 | 橙色 | 黄 |
| 石蕊 | 5.0~8.0 | 红 | 紫色 | 蓝 |
| 酚酞 | 8.2~10.0 | 无 | 粉红 | 红 |
 Ⅰ.铜与稀硝酸反应的离子方程式为
Ⅰ.铜与稀硝酸反应的离子方程式为在做铜与稀硝酸反应的实验时,常观察到试管内生成的气体先为浅红棕色,其原因是
为了能直接观察到生成的气体的颜色,可在往稀硝酸中加入铜的同时,加入少量碳酸盐,那么加入少量碳酸盐的作用是
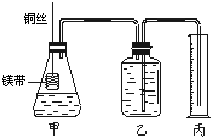
Ⅱ.某研究性学习小组欲证明:在同温同压下,相同浓度、相同体积的酸性不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如右图所示.该实验的主要操作步骤如下:
①配制浓度均为1mol?L-1盐酸和醋酸溶液;
②量取15.00mL 1mol?L-1盐酸和醋酸溶液分别加入两个锥形瓶中;
③分别称取除去表面氧化膜的镁带a g,并系于铜丝末端;
④在广口瓶中装足量的水,按图连接好装置,检查装置的气密性;
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触),至反应完全,记录相关数据;
⑥反应结束后待温度恢复到室温,调整乙和丙中液面使二者处于同一平面,读出量筒中水的体积为V mL.
请你参与实验并回答下列问题:
(1)量取15.00mL 1mol?L-1盐酸和醋酸溶液所用的仪器是
A.带刻度的烧杯 B.量筒 C.酸式滴定管 D.碱式滴定管
(2)步骤③中a的数值至少是
(3)本实验装置丙中量筒的规格是
A.10mL B.100mL C.200mL D.500mL
(4)若水蒸气的影响忽略不计,在实验室条件下,气体摩尔体积的计算式为:Vm=
(5)试简述速率不等的原因是
(6)试写出镁与醋酸溶液反应的离子方程式:
I.某校化学学习小组为了探究草酸(H2C2O4)的化学性质,设计了如下实验:
小组成员在做草酸溶液与酸性高锰酸钾溶液反应实验时发现,溶液褪色先慢后快。
(1)上述H2C2O4溶液与酸性KMnO4溶液反应的离子方程为 。
(2)为了探究此反应速率由小变大的原因,甲同学做了如下实验(表中“一”表示未加入该试剂)。
甲同学由此能够得出结论:
II.乙同学查资料得知“菠菜中富含可溶性草酸盐和碳酸盐”, 决定用实验验证这一事实并检测草酸盐含量。进一步查阅资料得知,草酸(H2C2O4)是酸性强于醋酸的二元弱酸,对应的钙盐(CaC2O4)不溶于醋酸,能溶于强酸。
(1) 欲准确测定菠菜中草酸盐含量,回答有关问题:
①操作:取m g菠菜样品,将其中草酸盐转化为 CaC2O4 沉淀分离出来,用盐酸溶解后,溶液转入100mL容量瓶中加水配制成100mL溶液。每次移取25.00mL该溶液,用0.0100mol·L-1 KMnO4标准溶液滴定,滴定实验重复操作2 —3次。平均消耗标准溶液V mL。
②计算:菠菜中草酸盐(以C2O42-计)的质量分数为 。(只列式不计算,已知:C2O42-的的摩尔质量为88 g?mol-1)
③讨论:用标准KMnO4溶液直接滴定菠菜研磨、浸泡、过滤得到的溶液结果可能偏高,原因是 。
小组成员在做草酸溶液与酸性高锰酸钾溶液反应实验时发现,溶液褪色先慢后快。
(1)上述H2C2O4溶液与酸性KMnO4溶液反应的离子方程为 。
(2)为了探究此反应速率由小变大的原因,甲同学做了如下实验(表中“一”表示未加入该试剂)。
| 实验 编号 | 反应温度 (利用水浴加热) | 稀硫酸 溶液 | MnSO4固体 | 0.10 mol/L KMnO4溶液 | 褪色 时间 |
| 1 | 750C | 一 | 一 | 1mL | 100s |
| 2 | 750C | 10滴 | 一 | 1mL | 40s |
| 3 | 750C | 10滴 | 加入少许 | 1mL | 3s |
II.乙同学查资料得知“菠菜中富含可溶性草酸盐和碳酸盐”, 决定用实验验证这一事实并检测草酸盐含量。进一步查阅资料得知,草酸(H2C2O4)是酸性强于醋酸的二元弱酸,对应的钙盐(CaC2O4)不溶于醋酸,能溶于强酸。
(1) 欲准确测定菠菜中草酸盐含量,回答有关问题:
①操作:取m g菠菜样品,将其中草酸盐转化为 CaC2O4 沉淀分离出来,用盐酸溶解后,溶液转入100mL容量瓶中加水配制成100mL溶液。每次移取25.00mL该溶液,用0.0100mol·L-1 KMnO4标准溶液滴定,滴定实验重复操作2 —3次。平均消耗标准溶液V mL。
②计算:菠菜中草酸盐(以C2O42-计)的质量分数为 。(只列式不计算,已知:C2O42-的的摩尔质量为88 g?mol-1)
③讨论:用标准KMnO4溶液直接滴定菠菜研磨、浸泡、过滤得到的溶液结果可能偏高,原因是 。
某校化学学习小组为了探究草酸(H2C2O4)的化学性质,设计了如下实验:
Ⅰ.小组成员在做草酸溶液与酸性高锰酸钾溶液反应实验时发现,溶液褪色先慢后快.
(1)上述H2C2O4溶液与酸性KMnO4溶液反应的离子方程为 .
(2)为了探究此反应速率由小变大的原因,甲同学做了如下实验(表中“一”表示未加入该试剂).
甲同学由此能够得出结论:
Ⅱ.乙同学查资料得知“菠菜中富含可溶性草酸盐和碳酸盐”,决定用实验验证这一事实并检测草酸盐含量.进一步查阅资料得知,草酸(H2C2O4)是酸性强于醋酸的二元弱酸,对应的钙盐(CaC2O4)不溶于醋酸,能溶于强酸.
(1)他将菠菜研磨成汁、热水浸泡、过滤得到溶液,调节溶液呈弱碱性,加入足量的CaCl2溶液,产生白色沉淀,过滤、洗涤沉淀备用,对生成的沉淀进行探究.
①提出合理假设:
假设1:只存在CaCO3;
假设2:既存在CaCO3,也存在CaC2O4;
假设3: .
②基于假设2,设计实验方案,进行实验.请写出实验步骤以及预期现象和结论.
限选实验试剂:1mol?L-1 H2SO4、1mol?L-1 HCl、0.1mol?L-1 NaOH、1mol?L-1 CaCl2、0.01mol?L-1 KMnO4、澄清石灰水.
(2)欲准确测定菠菜中草酸盐含量,回答有关问题:
①操作:取m g菠菜样品,将其中草酸盐转化为 CaC2O4 沉淀分离出来,用盐酸溶解后,溶液转入100mL容量瓶中加水配制成100mL溶液.每次移取25.00mL该溶液,用0.0100mol?L-1KMnO4标准溶液滴定,滴定实验重复操作2-3次.平均消耗标准溶液V mL.
②计算:菠菜中草酸盐(以C2O42-计)的质量分数为 .(只列式不计算,已知:C2O42-的摩尔质量为88g?mol-1)
③讨论:用标准KMnO4溶液直接滴定菠菜研磨、浸泡、过滤得到的溶液结果可能偏高,原因是 .
查看习题详情和答案>>
Ⅰ.小组成员在做草酸溶液与酸性高锰酸钾溶液反应实验时发现,溶液褪色先慢后快.
(1)上述H2C2O4溶液与酸性KMnO4溶液反应的离子方程为
(2)为了探究此反应速率由小变大的原因,甲同学做了如下实验(表中“一”表示未加入该试剂).
| 实验 编号 |
反应温度 (利用水浴加热) |
稀硫酸 溶液 |
MnSO4固体 | 0.10mol/L KMnO4溶液 |
褪色 时间 |
| 1 | 750℃ | ---- | --- | 1mL | 1OOs |
| 2 | 750℃ | 10滴 | ---- | 1mL | 40s |
| 3 | 750℃ | 10滴 | 加入少许 | 1mL | 3s |
Ⅱ.乙同学查资料得知“菠菜中富含可溶性草酸盐和碳酸盐”,决定用实验验证这一事实并检测草酸盐含量.进一步查阅资料得知,草酸(H2C2O4)是酸性强于醋酸的二元弱酸,对应的钙盐(CaC2O4)不溶于醋酸,能溶于强酸.
(1)他将菠菜研磨成汁、热水浸泡、过滤得到溶液,调节溶液呈弱碱性,加入足量的CaCl2溶液,产生白色沉淀,过滤、洗涤沉淀备用,对生成的沉淀进行探究.
①提出合理假设:
假设1:只存在CaCO3;
假设2:既存在CaCO3,也存在CaC2O4;
假设3:
②基于假设2,设计实验方案,进行实验.请写出实验步骤以及预期现象和结论.
限选实验试剂:1mol?L-1 H2SO4、1mol?L-1 HCl、0.1mol?L-1 NaOH、1mol?L-1 CaCl2、0.01mol?L-1 KMnO4、澄清石灰水.
| 实验步骤 | 预期现象和结论 |
| 步骤1: |
|
| 步骤2: |
①操作:取m g菠菜样品,将其中草酸盐转化为 CaC2O4 沉淀分离出来,用盐酸溶解后,溶液转入100mL容量瓶中加水配制成100mL溶液.每次移取25.00mL该溶液,用0.0100mol?L-1KMnO4标准溶液滴定,滴定实验重复操作2-3次.平均消耗标准溶液V mL.
②计算:菠菜中草酸盐(以C2O42-计)的质量分数为
③讨论:用标准KMnO4溶液直接滴定菠菜研磨、浸泡、过滤得到的溶液结果可能偏高,原因是