网址:http://m.1010jiajiao.com/timu3_id_358517[举报]
【化学――选修化学与技术】(15分)
氨在国民经济中占有重要地位,下图是合成氨的简要流程:
I.原料气的制备:
(1) 合成氨所需氮气来自空气,方法之一是将空气液化后再加热分馆;请另设计一种从空气中分离出氮气的方法:_________________________________________________________;
(2) 请写出工业上获得氢气的一种方法(用化学方程式表示)____________
II.原料气的净化:、
为防止催化剂“中毒”,原料气在进人压缩机之前必须经过净化、精制处理,“精制”过程通常是将含有少量CO、CO2、O2和H2S等杂质的原料气体通入含有氨水的醋酸亚铜二氨()溶液,以获得纯净原料气。其中,吸收CO的反应为:
(3) 为提髙CO吸收率,可采取的有效措施是__________________
(4) 除去氧气时,氧气将氧化为
,则反应中还原剂与氧化剂的物质的量之比是____________;
III.氨的合成:
(5)据报道,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了髙温常压下高转化率的电化学合成氨。其实验装置如图。请写出钯电极A上的电极反应式________________________
查看习题详情和答案>>
【化学――选修化学与技术】(15分)
氨在国民经济中占有重要地位,下图是合成氨的简要流程:
I.原料气的制备:
(1) 合成氨所需氮气来自空气,方法之一是将空气液化后再加热分馆;请另设计一种从空气中分离出氮气的方法:_________________________________________________________;
(2) 请写出工业上获得氢气的一种方法(用化学方程式表示)____________
II.原料气的净化:、
为防止催化剂“中毒”,原料气在进人压缩机之前必须经过净化、精制处理,“精制”过程通常是将含有少量CO、CO2、O2和H2S等杂质的原料气体通入含有氨水的醋酸亚铜二氨( )溶液,以获得纯净原料气。其中,吸收CO的反应为:
)溶液,以获得纯净原料气。其中,吸收CO的反应为:
(3) 为提髙CO吸收率,可采取的有效措施是__________________
(4) 除去氧气时,氧气将 氧化为
氧化为 ,则反应中还原剂与氧化剂的物质的量之比是____________;
,则反应中还原剂与氧化剂的物质的量之比是____________;
III.氨的合成:
(5)据报道,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了髙温常压下高转化率的电化学合成氨。其实验装置如图。请写出钯电极A上的电极反应式________________________
【化学――选修化学与技术】(15分)
氨在国民经济中占有重要地位,下图是合成氨的简要流程:

I.原料气的制备:
(1) 合成氨所需氮气来自空气,方法之一是将空气液化后再加热分馆;请另设计一种从空气中分离出氮气的方法:_________________________________________________________;
(2) 请写出工业上获得氢气的一种方法(用化学方程式表示)____________
II.原料气的净化:、
为防止催化剂“中毒”,原料气在进人压缩机之前必须经过净化、精制处理,“精制”过程通常是将含有少量CO、CO2、O2和H2S等杂质的原料气体通入含有氨水的醋酸亚铜二氨( )溶液,以获得纯净原料气。其中,吸收CO的反应为:
)溶液,以获得纯净原料气。其中,吸收CO的反应为:

(3) 为提髙CO吸收率,可采取的有效措施是__________________
(4) 除去氧气时,氧气将 氧化为
氧化为 ,则反应中还原剂与氧化剂的物质的量之比是____________;
,则反应中还原剂与氧化剂的物质的量之比是____________;

III.氨的合成:
(5)据报道,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了髙温常压下高转化率的电化学合成氨。其实验装置如图。请写出钯电极A上的电极反应式________________________
查看习题详情和答案>>
氨在国民经济中占有重要地位,下图是合成氨的简要流程:

I.原料气的制备:
(1) 合成氨所需氮气来自空气,方法之一是将空气液化后再加热分馆;请另设计一种从空气中分离出氮气的方法:_________________________________________________________;
(2) 请写出工业上获得氢气的一种方法(用化学方程式表示)____________
II.原料气的净化:、
为防止催化剂“中毒”,原料气在进人压缩机之前必须经过净化、精制处理,“精制”过程通常是将含有少量CO、CO2、O2和H2S等杂质的原料气体通入含有氨水的醋酸亚铜二氨(
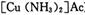 )溶液,以获得纯净原料气。其中,吸收CO的反应为:
)溶液,以获得纯净原料气。其中,吸收CO的反应为: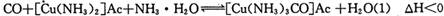
(3) 为提髙CO吸收率,可采取的有效措施是__________________
(4) 除去氧气时,氧气将
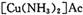 氧化为
氧化为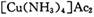 ,则反应中还原剂与氧化剂的物质的量之比是____________;
,则反应中还原剂与氧化剂的物质的量之比是____________;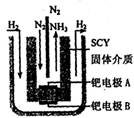
III.氨的合成:
(5)据报道,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了髙温常压下高转化率的电化学合成氨。其实验装置如图。请写出钯电极A上的电极反应式________________________
 .
.