网址:http://m.1010jiajiao.com/timu3_id_358425[举报]
反应4NH3(g) + 5O2(g) =" 4NO(g)" + 6H2O(g)在10L的密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率v(X)可表示为( )
| A.v(NH3)=0.01mol/L/s |
| B.v(O2)=0.001mol/L/s |
| C.v(NO)="0.001" mol/L/s |
| D.v(H2O)="0.045" mol/L/s |
(10分)接触法制硫酸的核心反应是2SO2(g) + O2(g) 2SO3(g);△H<0。在2L恒容的密闭容器中,加入3molSO3(g)和lmol氧气,在一定温度下使其反应,反应至4min时,氧气的浓度为0.6mol·L-1,当反应到8min时,反应到达平衡,此时c(SO3)=a mol·L-1。
(1) 0min~4min内生成O2平均速率v(O2)= ;如果0min~4min内SO3生成速率平均为x,4min~8min内SO3生成速率平均为y,8min~10min内SO3生成速率平均为z(其它条件不变,且忽略反应中温度变化),则x、y、z大小关系为______________。
(2) 达到平衡时c(O2)=c(SO2),则a= mol·L-1;如果此时在平衡体系中加入0.5molN2,则SO2在混合气中所占的体积分数____________(填“增大”、“减小”或“不变”)
(3) 若起始时n(SO3)、n(SO2)、n(O2)(/mol)分别按下列4组数据投料,相同温度下达到平衡时,三氧化硫浓度大于a mol·L-1的是 。
A.1、2、2 B.3、1.5、1 C.3、0、0 D.0、6、5
查看习题详情和答案>>
A.v(NH3)=0.010 mol·L-1·s-1 B.v(O2)=0.001 0 mol·L-1·s-1
C.v(NO)=0.001 0 mol·L-1·s-1 D.v(H2O)=0.045 mol·L-1·s-1
查看习题详情和答案>>(一)、将2 mol SO2和1 mol
O2气体在1L的容器中混合,在一定条件下发生如下反应:2SO2(g)+O2 (g) 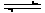 2SO3 (g)。若经过2s后测得SO3的浓度为0.6 mol/ L。试计算:(1)O2的化学反应速率V(O2)= ; (2)2s时的O2浓度 。
2SO3 (g)。若经过2s后测得SO3的浓度为0.6 mol/ L。试计算:(1)O2的化学反应速率V(O2)= ; (2)2s时的O2浓度 。
(二)、某温度时,在2 L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如下图所示。
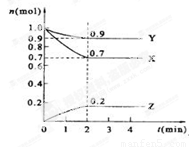
(1)X的转化率是
(2)由图中所给数据进行分析,该反应的化学方程式为 ;
(3)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)= ;
(4)当反应进行到第 min,该反应达到平衡。
查看习题详情和答案>>
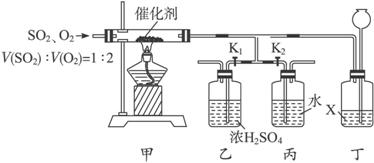
(1)写出黄铁矿与氧气反应的化学方程式_________________________________________。
(2)在工业生产中,与装置甲作用相同的设备名称是____________,与装置乙作用相同的设备名称是____________。
(3)反应中通入的V(SO2)∶V(O2)=1∶2,其目的是___________________________。
(4)实验时先关闭K1、打开K2,过一会儿再打开K1、关闭K2,在装置乙和丙中产生白雾的是____________。
(5)已知液体X既不易溶解硫的氧化物,也不易溶解氧气,则装置丁的作用是________________________。
(6)本套装置中有一处明显的缺陷,请指出____________________________________,改进的方法是____________________________________。
查看习题详情和答案>>