摘要:(1)正极.还原.O2 +2CO2-4e-=2 CO32- (2)2CO + O2 =2CO2 O2+ 2H2 =2H2O
网址:http://m.1010jiajiao.com/timu3_id_357856[举报]
(1)一种新型锂电池是将化学式为Li4Ti5O12的物质作为电池的正极材料,在放电的过程中变为化学式为Li4Ti5O12的物质.
①Li4Ti5O12中Ti元素的化合价为 ,锂电池的突出优点是 .
②该锂电池是一种二次电池,放电时的负极反应式为 ,充电时的阳极反应式为 .
(2)用氧化还原滴定法测定制备得到的TiO2试样中的TiO2的质量分数:在一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作为指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.
①TiCl4水解生成TiO2?xH2O的化学方程式为 .
②滴定终点的现象是 .
③滴定分析时,称取TiO2试样0.2g,消耗0.1mol?L-1 NH4Fe(SO4)2栎准溶液20ml.则TiO2的质量分数为 .
④若在滴定终点,读取滴定管刻度时,俯视标准溶液的液面,使其测定结果 (填“偏大”、“偏小”或“无影响”)o
(3)已知:
Ti(s)+2Cl2(g)=TiCl4(l)△H=-804.2kJ?mol-1
2Na(s)+Cl2(g)=2NaCl(s)△H=-882.0kJ?mol-1
Na(s)=Na(l)△H=+2.6kJ?mol-1
则TiCl4(l)+4Na(l)=Ti(s)+4NaCl(s)的△H= KJ?mol-1.
查看习题详情和答案>>
①Li4Ti5O12中Ti元素的化合价为
②该锂电池是一种二次电池,放电时的负极反应式为
(2)用氧化还原滴定法测定制备得到的TiO2试样中的TiO2的质量分数:在一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作为指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.
①TiCl4水解生成TiO2?xH2O的化学方程式为
②滴定终点的现象是
③滴定分析时,称取TiO2试样0.2g,消耗0.1mol?L-1 NH4Fe(SO4)2栎准溶液20ml.则TiO2的质量分数为
④若在滴定终点,读取滴定管刻度时,俯视标准溶液的液面,使其测定结果
(3)已知:
Ti(s)+2Cl2(g)=TiCl4(l)△H=-804.2kJ?mol-1
2Na(s)+Cl2(g)=2NaCl(s)△H=-882.0kJ?mol-1
Na(s)=Na(l)△H=+2.6kJ?mol-1
则TiCl4(l)+4Na(l)=Ti(s)+4NaCl(s)的△H=
下图是元素周期表的短周期部分,序号a~h代表8种常见元素.
请用相应的化学用语回答下列问题:
(1)画出g原子结构示意图
 .
.
(2)写出元素h的单质与元素a、c形成的简单化合物发生置换反应的化学方程式
(3)写出f单质与a、d、e三种元素形成的化合物水溶液反应的化学方程式
(4)a、b元素形成的最简单化合物与d单质可组成燃料电池(以KOH溶液作电解质溶液),写出正极的电极反应式:
查看习题详情和答案>>
| IA | O族 | |||||||||
| 第一周期 | a | IIA | IIIA | IVA | VA | VIA | VIIA | |||
| 第二周期 | b | c | d | |||||||
| 第三周期 | e | f | g | h | ||||||
(1)画出g原子结构示意图


(2)写出元素h的单质与元素a、c形成的简单化合物发生置换反应的化学方程式
3Cl2+2NH3=N2+6HCl
3Cl2+2NH3=N2+6HCl
.(3)写出f单质与a、d、e三种元素形成的化合物水溶液反应的化学方程式
2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑
2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑
.(4)a、b元素形成的最简单化合物与d单质可组成燃料电池(以KOH溶液作电解质溶液),写出正极的电极反应式:
O2+2H20+4e-=4OH-
O2+2H20+4e-=4OH-
,负极发生氧化
氧化
反应(填“氧化”或“还原”),OH-移向负
负
极.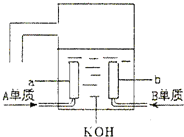 A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A与C,B与D分别是同主族元素;已知B、D二元素原子核中质子数之和是A、C二元素原子核中质子数之和的2倍;四种元素形成的单质中有两种是气体,两种是固体.请回答以下问题:
A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A与C,B与D分别是同主族元素;已知B、D二元素原子核中质子数之和是A、C二元素原子核中质子数之和的2倍;四种元素形成的单质中有两种是气体,两种是固体.请回答以下问题:(1)写出由A、B两元素形成的原子个数比为1:1的化合物的化学式
H2O2
H2O2
,此化合物能使酸性KMnO4溶液退色,体现该化合物具有还原性
还原性
性.(2)D元素在元素周期表中的位置
第三周期第ⅥA族
第三周期第ⅥA族
,B和C两元素形成的原子个数比为1:1的化合物中含有的化学键的类型为离子键、共价键
离子键、共价键
.(3)A、B、C、D四种原子半径由大到小为
Na>S>O>H
Na>S>O>H
(填元素符号);四种离子半径由大到小为S2->O2->Na+>H+
S2->O2->Na+>H+
(填离子符号).(4)写出由A、B两元素形成的原子个数比为2:1的化合物与B、C两元素形成的原子个数比为1:1的化合物反应的离子方程式
2Na2O2+2H2O=4Na++4OH-+O2↑
2Na2O2+2H2O=4Na++4OH-+O2↑
.(5)两种物质均由A、B、C、D四种元素组成,写出它们在水溶液中反应的离子方程式
HSO3-+H+=SO2↑+H2O
HSO3-+H+=SO2↑+H2O
.(6)用A元素的单质与B元素的单质可制成新型的化学电源,已在宇宙飞船中使用.其构造如图所示.两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电.则a是
负
负
极,电极反应式为4H2-4e-=4H+
4H2-4e-=4H+
,b是正
正
极,电极反应式为O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
.下图是周期表的一部分,试回答下列问题:
(1)元素②有两种原子10X和9X,下列说法正确的是
a.是同一种核素 b.具有相同的中子数
c.几乎具有相同的化学性质 d.具有相同的物理性质
①与⑦具有相似的化学性质,写出①的氯化物水解反应的化学方程式
(2)⑩和(11)两元素形成的某化合物可作为干燥剂,试写出其电子式
 .
.
(3)③④⑤⑥四种元素氢化物的沸点由低到高排列为
(4)元素⑨X的单质和元素④Y的最高价氧化物的水化物反应的还原产物为YO和YO2,且YO和YO2的物质的量之比为1:1,写出该反应的化学方程式
(5)⑧号元素M形成的盐K2MO4是一种强氧化剂,可作为水处理剂和高容量电池的材料.与MnO2-Zn电池相似,K2MO4-Zn也可以组成碱性电池,其正极反应式为
查看习题详情和答案>>
| ① | ② | ③ | ④ | ⑤ | ⑥ | |||||||||||||||
| ⑦ | ⑩ | |||||||||||||||||||
| ⑾ | ⑧ | ⑨ | ||||||||||||||||||
c
c
a.是同一种核素 b.具有相同的中子数
c.几乎具有相同的化学性质 d.具有相同的物理性质
①与⑦具有相似的化学性质,写出①的氯化物水解反应的化学方程式
BeCl2+2H2O Be(OH)2+2HCl
Be(OH)2+2HCl
 Be(OH)2+2HCl
Be(OH)2+2HClBeCl2+2H2O Be(OH)2+2HCl
Be(OH)2+2HCl
. Be(OH)2+2HCl
Be(OH)2+2HCl(2)⑩和(11)两元素形成的某化合物可作为干燥剂,试写出其电子式


(3)③④⑤⑥四种元素氢化物的沸点由低到高排列为
O>F>N>C
O>F>N>C
(用元素符号表示).(4)元素⑨X的单质和元素④Y的最高价氧化物的水化物反应的还原产物为YO和YO2,且YO和YO2的物质的量之比为1:1,写出该反应的化学方程式
2Se+6HNO3═3NO+3NO2+2H2SeO4+H2O
2Se+6HNO3═3NO+3NO2+2H2SeO4+H2O
.(5)⑧号元素M形成的盐K2MO4是一种强氧化剂,可作为水处理剂和高容量电池的材料.与MnO2-Zn电池相似,K2MO4-Zn也可以组成碱性电池,其正极反应式为
2FeO42-+8H2O+6e-═2Fe(OH)3+10OH-
2FeO42-+8H2O+6e-═2Fe(OH)3+10OH-
总反应的离子反应式为3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)3+4OH-
3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)3+4OH-
.(9分)、下图是元素周期表的短周期部分,序号a~h代表8种常见元素。
|
|
IA[ |
[来源:Zxxk.Com] |
O族 |
|||||
|
第一周期 |
a |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
|
|
第二周期 |
|
|
|
b |
c |
d |
|
|
|
第三周期 |
e |
|
f[ |
|
|
g |
h |
|
请用相应的化学用语回答下列问题:
(1)画出g原子结构示意图________。
(2)写出元素h的单质与元素a、c形成的简单化合物发生置换反应的化学方程式___________________。
(3)写出f单质与a、d、e三种元素形成的化合物水溶液反应的化学方程式__________。
(4)a、b元素形成的最简单化合物与d单质可组成燃料电池(以KOH溶液作电解质溶液),写出正极的电极反应式: _____________,负极发生______反应(填“氧化”或“还原”),OH-移向____极。
查看习题详情和答案>>