网址:http://m.1010jiajiao.com/timu3_id_357810[举报]
三氟化溴溶于水可发生如下反应:
3BrF3+5H2O![]() HBrO3+Br2+9HF↑+O2↑
HBrO3+Br2+9HF↑+O2↑
(1)其中发生自身氧化还原反应的物质是________;
(2)当有5个水分子参加反应时,由水还原的BrF3的个数是________,由BrF3还原的BrF3的个数是________;
(3)当有5个水分子作还原剂参加化学反应时,由水还原的BrF3的个数是________,由BrF3还原的BrF3的个数是________;
(4)当有5个水分子未参加氧化还原反应时,由水还原的BrF3的个数是________,由BrF3还原的BrF3的个数是________.
(15分)(1)、美国化学家富兰克林提出了酸碱的溶剂理论,对酸碱定义如下:在某溶剂的溶液中,凡能解离产生该溶剂阳离子的物质为酸;凡能解离产生该溶剂阴离子的物质为碱。这一理论不仅概括了水溶液中的酸碱概念,而且把酸碱概念引入非水溶剂,例如在液氨中2 NH3![]() NH4++NH2-铵盐(如 NH4Cl )表现为酸,氨基化物(如NaNH2)表现为碱。常见的无机非水溶剂有液态氨、硫酸、液态氟化氢、液态二氧化硫、三氟化溴等。已知液体SO2和纯水的导电性相近,实验测得两者的比导电值分别为 8×10-8Ω-1?cm-1和8×10-8Ω-1?cm-1。试用简要的文字和化学反应方程式给出解释:为什么在SO2的液体中,可用Cs2SO3去滴定SOCl2?
NH4++NH2-铵盐(如 NH4Cl )表现为酸,氨基化物(如NaNH2)表现为碱。常见的无机非水溶剂有液态氨、硫酸、液态氟化氢、液态二氧化硫、三氟化溴等。已知液体SO2和纯水的导电性相近,实验测得两者的比导电值分别为 8×10-8Ω-1?cm-1和8×10-8Ω-1?cm-1。试用简要的文字和化学反应方程式给出解释:为什么在SO2的液体中,可用Cs2SO3去滴定SOCl2?
(2)①已知盐酸是强酸,氢氟酸是弱酸。在室温下0.20mol/L氢氟酸水溶液中,氟离子的浓度是0.011mol/L,则氢氟酸的电离常数为 ; 取1.0L 0.20mol/L氢氟酸水溶液与1.0L 0.20mol/L盐酸混合,则溶液中氢离子、氟离子和氢氟酸的浓度各为 、 、 。
②某温度下,K(CH3COOH)=1.0×10-5,若醋酸的起始浓度为0.l0mol/L ,则平衡时溶液的pH是多少?(写出计算过程)
(3)①已知:Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10,向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,c (Br-)/c (Cl-) = 。②常温下,CaCO3和CaSO4的溶解度分别为1.5×10-3g和2.1×10-1g,往CaSO4悬浊液中通入CO2可得到CaCO3,请解析CaSO4向CaCO3转化的原因。
查看习题详情和答案>>
纯三氟化氮(NF3)在集成电路、大型屏幕液晶显示屏(TFT-LCD)的生产中,作为清洗剂之用。
三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,请根据要求回答下列问题:
(1)写出该反应的化学方程式。 。
(2)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现。你判断该气体泄漏时的现象是 。
(3)一旦NF3泄漏,可以用喷淋 溶液的方法减少污染。
(4)一种生产NF3的方法:氟气与液态氟化氢铵(NH4HF2)反应,产生NF3。
写出该反应的化学方程式:
查看习题详情和答案>>纯三氟化氮(NF3)在集成电路、大型屏幕液晶显示屏(TFT-LCD)的生产中,作为清洗剂之用。三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,请根据要求回答下列问题:
(1)NF3的电子式为 。
(2)写出该反应的化学方程式。 。
(3)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现。你判断该气体泄漏时的现象是 。
(4)一旦NF3泄漏,可以用喷淋 溶液的方法减少污染。
(5)一种生产NF3的方法:氟气与液态氟化氢铵(NH4HF2)反应,产生NF3。写出该反应的化学方程式:
查看习题详情和答案>> 实验室用图装置制取少量溴苯,回答下列问题.
实验室用图装置制取少量溴苯,回答下列问题.(1)在烧瓶a中装的试剂是
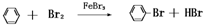
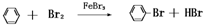
(2)跟烧瓶口垂直的一段长导管的作用是
(3)C中盛放CCl4的作用是
(4)生成的溴苯因溶有未反应的溴而显褐色,提纯的方法是
(5)能证明苯和液溴发生的是取代反应,而不是加成反应,可向锥形瓶C中加入AgNO3溶液,若
(6)实验结束时,将氢氧化钠溶液倒入烧瓶中,充分振荡,目的是