摘要:Cl2.Br2.I2.HClO; KCl.I2; KCl
网址:http://m.1010jiajiao.com/timu3_id_357572[举报]
(2012?上海)图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸.向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面.已知:2KMnO4+16HCl→2KCl+5Cl2↑+2MnCl2+8H2O 对实验现象的“解释或结论”正确的是( )
|
查看习题详情和答案>>
根据下列实验装置及现象,可以得到相应结论的是( )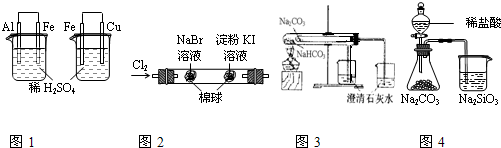
查看习题详情和答案>>

| 实验现象 | 结论 | |
| A | 图1左烧杯中铁表面有气泡,右烧杯中铜表面有气泡 | 活动性:Al>Fe>Cu |
| B | 图2左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
| C | 图3左边烧杯变浑浊,右边烧杯不变浑浊 | 热稳定性:Na2CO3>NaHCO3 |
| D | 图4锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
 (2011?濮阳二模)A、B、C、D、E五种元素都是36号以前元素,原子序数依次增大,其相关信息如下表
(2011?濮阳二模)A、B、C、D、E五种元素都是36号以前元素,原子序数依次增大,其相关信息如下表| 元素 | 相关信息 |
| A | A的第一电离能低于同周期相邻元素 |
| B | B原子中成对电子数等于未成对电子数的2倍 |
| C | C原子p轨道和s轨道中的电子数相等,与非金属的原子结合时形成共价键 |
| D | D与A、B、C均不同周期,其单质分子中只有一条共价键 |
| E | E在所处周期中电负性最大,且与D是同一主族元素 |
B
B
BC
C
CO
O
DCl
Cl
,EBr
Br
;(2)A与D形成的化合物的化学式为
BCl3
BCl3
,其分子的立体构型是平面正三角形
平面正三角形
,是非极性
非极性
(填“极性”或“非极性”)分子;(3)请比较化合物ED与Cl2、Br2、I2三者沸点由高到低的顺序:
I2
I2
>Br2
Br2
>BrCl
BrCl
>Cl2
Cl2
,其理由是
BrCl与Cl2、Br2、I2结构相似,都能形成分子晶体,相对分子质量越大,分子间作用力越强,沸点越高
BrCl与Cl2、Br2、I2结构相似,都能形成分子晶体,相对分子质量越大,分子间作用力越强,沸点越高
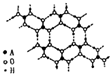
.(4)A的最高价氧化物的水化物(H2AO3)晶体是一种白色片层状结构,层内的H3AO3分子这间有序排列如图.
①在H3AO3分子中,A原子的杂化方式是
sp2
sp2
;②在晶体中,H3AO3分子能形成这种排列方式的原因是
H3BO3分子之间氢原子与氧原子之间存在氢键
H3BO3分子之间氢原子与氧原子之间存在氢键
;③在H3AO3晶体中层与层之间的作用力是
分子间作用力
分子间作用力
,该晶体属于分子
分子
晶体.