摘要:2.氨催化氧化法制HNO3有关事项 (1)为提高原料转化率.应补充空气.多次氧化和吸收 (2)尾气吸收--用碱液 NO+NO2+2NaOH=2NaNO2+H2O 2NO2+2NaOH=NaNO3+NaNO2+H2O 当n:n≥1.均可被吸收完全 (3)硝酸浓度的提高 ①吸水剂 ②蒸发 浓H2SO4或Mg(NO3)2 稀硝酸 浓缩
网址:http://m.1010jiajiao.com/timu3_id_357369[举报]
 科学家一直致力于“人工固氮”的新方法研究.
科学家一直致力于“人工固氮”的新方法研究.(1)传统“人工固氮”的反应为N2(g)+3H2(g)?2NH3(g).一定温度下,将1molN2和3molH2通入到体积为0.5L的密闭容器中,达到平衡状态时H2的转化率为50%,该温度下该反应的平衡常数K=
| 4 |
| 27 |
| 4 |
| 27 |
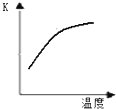
(2)最新“人工固氮”的研究报道:常温常压、光照条件下,N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)═4NH3 (g)+3O2(g)△H=Q kJ?mol-1
①已知该反应的平衡常数K与温度的关系如右图,则此反应的Q
>
>
0 (填“>”“<”或“=”).②将反应生成的混合气体通入水中即可得氨水.用水稀释0.1mol?L-1氨水,溶液中随着水量的增加而增大的是
D
D
(填字母标号).A.
| c(NH3?H2O) |
| c(OH-) |
| c(NH4+)?c(OH-) |
| c(NH3?H2O) |
C.c(H+)?c(OH-) D.
| c(H+) |
| c(OH-) |
(3)氨催化氧化法制硝酸的主要反应为:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H<0;在容积为1升的密闭容器中发生该反应,容器内部分物质的含量如下表:
| 时间/物质的量 | n(NH3) (mol) | n(O2 ) (mol) | n(NO) (mol) |
| 起始 | 1.600 | 3.200 | 0.000 |
| 第2min | a | 2.700 | 0.4000 |
| 第4min | 0.600 | 1.950 | 1.000 |
| 第6min | 0.600 | 1.950 | 1.000 |
0.3
0.3
mol/(L?min).②对于上述反应的下列判断,正确的是
D
D
(填序号).A.若升高反应体系的温度,平衡时体系中NH3%将减小
B.若增大反应体系的压强,平衡时体系中NO%将增大
C.若升高反应体系的温度,平衡时体系中H2O%将增加
D.不论该反应是否在催化剂存在的条件下进行,平衡时体系中O2%保持不变.
(2013?济宁二模)如图表示某些化工生产的流程(部分反应条件和产物略去)

(1)反应Ⅰ需在500℃进行,其主要原因是
(2)G转化为H的过程中,需要不断补充空气,其原因是
(3)写出反应Ⅲ的化学方程式
(4)工业上,向析出K的母液中通氨气,加入细小食盐颗粒,冷却后可析出副产品.通入氨气的作用是
a.增大NH+4的浓度,使J更多地析出
b.使K更多地析出
c.使K转化为M,提高析出的J的纯度
(5)写出上述流程所涉及的化学工业的名称
查看习题详情和答案>>

(1)反应Ⅰ需在500℃进行,其主要原因是
此温度下催化剂的活性最大
此温度下催化剂的活性最大
.(2)G转化为H的过程中,需要不断补充空气,其原因是
使NO不断转化为NO2,提高原料的利用率
使NO不断转化为NO2,提高原料的利用率
.(3)写出反应Ⅲ的化学方程式
NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
.(4)工业上,向析出K的母液中通氨气,加入细小食盐颗粒,冷却后可析出副产品.通入氨气的作用是
ac
ac
(填序号).a.增大NH+4的浓度,使J更多地析出
b.使K更多地析出
c.使K转化为M,提高析出的J的纯度
(5)写出上述流程所涉及的化学工业的名称
合成氨工业,氨催化氧化法制硝酸,侯德榜制碱法
合成氨工业,氨催化氧化法制硝酸,侯德榜制碱法
.