摘要:1]8 HOOCCH2CH2COOH+KOH=HOOCCH2CH2COOK↓+H2O (3)HOOCCH2CH2COOK+KOH=KOOCCH2CH2COOK↓+H2O
网址:http://m.1010jiajiao.com/timu3_id_357028[举报]
用粗锌(含少量Fe等杂质)与稀硫酸反应制氢气,其废液中含有大量的硫酸锌.同学们用制氢气的废液来制取皓矾(ZnSO4?7H2O),并探究其性质.
(l)制备皓矾 实验流程如下图所示:

已知:氢氧化物沉淀的pH范围见下表.
请回答下列问题:
①加入的试剂a,供选择使用的有:氨水、NaClO溶液、20%的H2O2、浓硫酸、浓硝酸等,应选用 ,其理由是 .
②加入的试剂b,供选择使用的有:Zn粉、ZnO、Zn(OH)2、ZnCO3、ZnSO4等,应选用 ,其理由是 .
③从晶体l→晶体2,该过程的名称是 .
④在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是 .
(2)探究皓矾的性质
⑤称取28.7g ZnSO4?7H2O研细后置于坩埚中小心加热,其固体质量与温度的对应数据见上表.则1000℃时皓矾的反应方程式为 .
⑥取少量ZnSO4?7H2O配成溶液向其中逐滴加入NaOH溶液,发现先产生白色沉淀后又逐渐溶解.查资料得知Zn(OH)2具有两性,则Zn(OH)2溶于NaOH溶液的离子方程式为: .
查看习题详情和答案>>
(l)制备皓矾 实验流程如下图所示:

已知:氢氧化物沉淀的pH范围见下表.
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 5.7 |
| 完全沉淀pH | 3.7 | 9.6 | 8.0 |
①加入的试剂a,供选择使用的有:氨水、NaClO溶液、20%的H2O2、浓硫酸、浓硝酸等,应选用
②加入的试剂b,供选择使用的有:Zn粉、ZnO、Zn(OH)2、ZnCO3、ZnSO4等,应选用
③从晶体l→晶体2,该过程的名称是
④在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是
(2)探究皓矾的性质
| 温度(℃) | 60 | 240 | 930 | 1000 |
| 残留固体质量(g) | 19.7 | 16.1 | 8.1 | 8.1 |
⑥取少量ZnSO4?7H2O配成溶液向其中逐滴加入NaOH溶液,发现先产生白色沉淀后又逐渐溶解.查资料得知Zn(OH)2具有两性,则Zn(OH)2溶于NaOH溶液的离子方程式为:
把一定量的Na2O2的NaHCO3的混合粉末分为两等份,将其中一份加入100mL稀盐酸中恰好完全反应,生成的气体干燥后体积为2.24L(标准状况下);再将此气体通入另一份混合物中,充分反应后,得到O2 2.016L(标准状况下),则原混合粉末中Na2O2和NaHCO3的物质的量之比及稀盐酸的物质的量浓度是( )
|
查看习题详情和答案>>
(2011?锦州模拟)海水资源丰富,海水中主要含有Na+、K+、Mg2+、Cl-、SO2-4、Br-、CO2-3、HCO-3等离子.合理利用海水资源和保护环境是我国可持续发展的重要保证.
Ⅰ.火力发电燃烧煤排放的SO2会造成一系列环境和生态问题.利用海水脱硫是一种有效的方法,其工艺流程如下图所示:
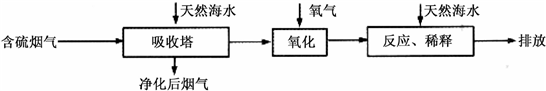
(1)天然海水的pH≈8,呈弱碱性.用离子方程式解释原因
(2)天然海水吸收了含硫烟气后,要用O2进行氧化处理,其反应的化学方程式是
Ⅱ.重金属离子对河流及海洋造成严重污染.某化工厂废水(pH=2.0,ρ≈1g?mL-1)中含有Ag+、Pb2+等重金属离子,其浓度各约为0.1mol?L-1.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
(3)你认为往废水中投入
A.NaOH B.Na2S C.KID.Ca(OH)2
(4)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=
(5)如果用食盐处理其只含Ag+的废水,测得处理后的废水中NaCl的质量分数为0.117%.若环境要求排放标准为c(Ag+)低于1.0×10-8mol?L-1,问该工厂处理后的废水中c(Ag+)=
已知KSP(AgCl)=1.8×1-10mol?L2.
查看习题详情和答案>>
Ⅰ.火力发电燃烧煤排放的SO2会造成一系列环境和生态问题.利用海水脱硫是一种有效的方法,其工艺流程如下图所示:

(1)天然海水的pH≈8,呈弱碱性.用离子方程式解释原因
CO32-+H2O?HCO3-+OH-或HCO3-+H2O?H2CO3+OH-
CO32-+H2O?HCO3-+OH-或HCO3-+H2O?H2CO3+OH-
.(2)天然海水吸收了含硫烟气后,要用O2进行氧化处理,其反应的化学方程式是
2H2SO3+O2═2H2SO4
2H2SO3+O2═2H2SO4
;氧化后的“海水”需要用大量的天然海水与之混合后才能排放,该操作的主要目的是中和、稀释经氧气氧化后海水中生成的酸
中和、稀释经氧气氧化后海水中生成的酸
.Ⅱ.重金属离子对河流及海洋造成严重污染.某化工厂废水(pH=2.0,ρ≈1g?mL-1)中含有Ag+、Pb2+等重金属离子,其浓度各约为0.1mol?L-1.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
| 难溶电解质 | AgI | AgOH | Ag2S | pbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
B
B
(填字母序号),沉淀效果最好.A.NaOH B.Na2S C.KID.Ca(OH)2
(4)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=
1.2×10-3mol?L-1
1.2×10-3mol?L-1
.(5)如果用食盐处理其只含Ag+的废水,测得处理后的废水中NaCl的质量分数为0.117%.若环境要求排放标准为c(Ag+)低于1.0×10-8mol?L-1,问该工厂处理后的废水中c(Ag+)=
9×10-9mol?L-1
9×10-9mol?L-1
,是否符合排放标准是
是
(填“是”或“否”).已知KSP(AgCl)=1.8×1-10mol?L2.
已知某条件下,合成氨反应的数据如下表
当用氨气浓度的增加来表示该反应的速率时,下列说法错误的是( )
| N2(g)+3H2(g)?2NH3(g) | |||
| N2 | H2 | NH3 | |
| 起始浓度mol/L | 1.0 | 3.0 | 0.2 |
| 2s末浓度mol/L | 0.6 | 1.8 | 1.0 |
| 4s末浓度mol/L | 0.4 | 1.2 | 1.4 |
| A、2s末氨气的反应速率为0.4mol/(L?s) |
| B、前2s时间内氨气的平均反应速率为0.4mol/(L?s) |
| C、前4s时间内氨气的平均反应速率为0.3mol/(L?s) |
| D、2s~4s时间内氨气的平均反应速率为0.2mol/(L?s) |
(2013?淮南一模)从废钒催化剂(主要成分有V2O5,VOSO4,K2SO4,SiO2等)中回收V2O5的一种生产流程示意图如下,请回答下列问题:
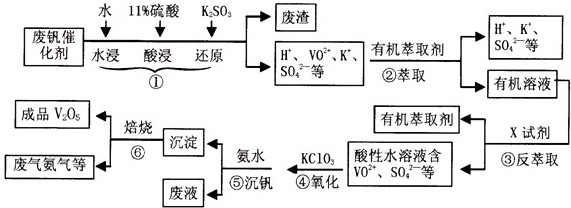
(1)步骤①中废渣的主要成分是
(2)实验室中进行萃取分液操作时,注入萃取剂,充分振荡,将分液漏斗于铁圈上静置,当液体分层后,接下来的操作是
(3)②③的变化过程可简化为(下式R表示VO 2+,HA表示有机萃取剂)
R2(SO4)n(水层)+2nHA(有机层)?2RAn(有机层)+nH2SO4(水层)
为提高②中萃取百分率,应采取的措施是
(4)请完成④中反应的离子方程式:
(5)25°C时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如表
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH值为
(6)该工艺流程中,可以循环利用的物质有
查看习题详情和答案>>

(1)步骤①中废渣的主要成分是
SiO2
SiO2
,③中X试剂为H2SO4
H2SO4
;(均填化学式)(2)实验室中进行萃取分液操作时,注入萃取剂,充分振荡,将分液漏斗于铁圈上静置,当液体分层后,接下来的操作是
打开分液漏斗瓶塞(或瓶塞凹槽对准瓶口小孔);当分液面接近(或略超过)活塞处时关闭活塞;上层液体从分液漏斗上口倒入另一烧杯中
打开分液漏斗瓶塞(或瓶塞凹槽对准瓶口小孔);当分液面接近(或略超过)活塞处时关闭活塞;上层液体从分液漏斗上口倒入另一烧杯中
;(3)②③的变化过程可简化为(下式R表示VO 2+,HA表示有机萃取剂)
R2(SO4)n(水层)+2nHA(有机层)?2RAn(有机层)+nH2SO4(水层)
为提高②中萃取百分率,应采取的措施是
加入碱中和硫酸使平衡正移
加入碱中和硫酸使平衡正移
;(4)请完成④中反应的离子方程式:
1
1
ClO3-+6
6
VO2++6
6
H-+=6
6
VO3++1Cl-
1Cl-
+3H2O
3H2O
(5)25°C时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如表
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
1.7-1.8
1.7-1.8
;(6)该工艺流程中,可以循环利用的物质有
氨气 有机萃取剂
氨气 有机萃取剂
.