摘要:,因为Vc易被空气中O2氧化.剧烈摇动会影响测定结果 27.,HCO3- + H2O == H2CO3 + OH- .溶液变浑.红色加深,Mg2+ + 2HCO3- == Mg(OH)2 + 2CO2
网址:http://m.1010jiajiao.com/timu3_id_356560[举报]
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其平衡常数K与温度t的关系如下表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=
.
(2)能判断该反应是否达到化学平衡状态的依据是
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式:c(CO2)?c(H2)=c(CO)?c(H2O),试判断此时的温度为
查看习题详情和答案>>
| T | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=
| C(CO)?C(H2O) |
| C(CO2)?C(H2) |
| C(CO)?C(H2O) |
| C(CO2)?C(H2) |
(2)能判断该反应是否达到化学平衡状态的依据是
bc
bc
(多选扣分).a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式:c(CO2)?c(H2)=c(CO)?c(H2O),试判断此时的温度为
830
830
℃.在此温度下,若该容器中含有1molCO2、1.2molH2、0.75molCO、1.5molH2O,这状态否
否
(是或否)处于平衡状态?若不是,反应向哪个方向进行?反应向正反应方向进行
反应向正反应方向进行
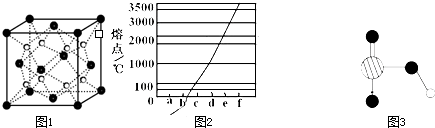
.(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等.
①基态Fe3+的M层电子排布式为 .
②尿素(H2NCONH2)分子中C、N原子的杂化方式分别是 、 ;C、N都能和O形成原子个数比为1:3的常见微粒,推测这两种微粒的空间构型为 .
③配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x= . Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型);
(2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如图1,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 .已知该晶胞的密度为ρ g/cm3,阿伏加德罗常数为NA,求晶胞边长a= cm. (用含ρ、NA的计算式表示)
(3)下列说法正确的是 .
A.第一电离能大小:S>P>Si
B.电负性顺序:C<N<O<F
C.因为晶格能CaO比KCl高,所以KCl比CaO熔点低
D.SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大
E.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
(4)图2是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体.
①图中d单质的晶体堆积方式类型是 .
②单质a、b、f 对应的元素以原子个数比1:1:1形成的分子中含 个σ键, 个π键.
③图3是上述六种元素中的一种元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因: .
查看习题详情和答案>>
①基态Fe3+的M层电子排布式为
②尿素(H2NCONH2)分子中C、N原子的杂化方式分别是
③配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=
(2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如图1,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为
(3)下列说法正确的是
A.第一电离能大小:S>P>Si
B.电负性顺序:C<N<O<F
C.因为晶格能CaO比KCl高,所以KCl比CaO熔点低
D.SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大
E.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
(4)图2是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体.
①图中d单质的晶体堆积方式类型是
②单质a、b、f 对应的元素以原子个数比1:1:1形成的分子中含
③图3是上述六种元素中的一种元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因:

A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中A、D及C、F分别是同一主族元素.A、C两元素可形成原子个数之比为2:1、1:1型化合物.B元素的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数.F元素的最外层电子数是次外层电子数的0.75倍.请回答:
(1)由E、F两种元素组成的化合物1mol跟由A、C、D三种元素组成的化合物的溶液发生反应,消耗后者物质的量最大值为
(2)A、C、F间形成的甲、乙两种微粒,甲有18个电子,乙有10个电子,它们均为负一价双原子阴离子,则甲与乙反应的离子方程式为
(3)工业上在高温的条件下,可以用A2C和BC反应制取单质A2.在等体积的Ⅰ、Ⅱ两个密闭容器中分别充入1molA2C和1molBC、2molA2C和2molBC.一定条件下,充分反应后分别达到平衡(两容器温度相同).下列说法正确的是
A.达到平衡所需要的时间:Ⅰ>ⅡB.达到平衡后A2C的转化率:Ⅰ=Ⅱ
C.达到平衡后BC的物质的量:Ⅰ>ⅡD.达到平衡后A2的体积分数:Ⅰ<Ⅱ
E.达到平衡后吸收或放出的热量:Ⅰ=Ⅱ
F.达到平衡后体系的平均相对分子质量:Ⅰ<Ⅱ
(4)用B元素的单质与E元素的单质可以制成电极浸入由A、C、D三种元素组成的化合物的溶液中构成电池,则电池负极的电极反应式是
查看习题详情和答案>>
(1)由E、F两种元素组成的化合物1mol跟由A、C、D三种元素组成的化合物的溶液发生反应,消耗后者物质的量最大值为
8
8
mol.(2)A、C、F间形成的甲、乙两种微粒,甲有18个电子,乙有10个电子,它们均为负一价双原子阴离子,则甲与乙反应的离子方程式为
HS-+OH-=S2-+H2O
HS-+OH-=S2-+H2O
.(3)工业上在高温的条件下,可以用A2C和BC反应制取单质A2.在等体积的Ⅰ、Ⅱ两个密闭容器中分别充入1molA2C和1molBC、2molA2C和2molBC.一定条件下,充分反应后分别达到平衡(两容器温度相同).下列说法正确的是
AB
AB
.A.达到平衡所需要的时间:Ⅰ>ⅡB.达到平衡后A2C的转化率:Ⅰ=Ⅱ
C.达到平衡后BC的物质的量:Ⅰ>ⅡD.达到平衡后A2的体积分数:Ⅰ<Ⅱ
E.达到平衡后吸收或放出的热量:Ⅰ=Ⅱ
F.达到平衡后体系的平均相对分子质量:Ⅰ<Ⅱ
(4)用B元素的单质与E元素的单质可以制成电极浸入由A、C、D三种元素组成的化合物的溶液中构成电池,则电池负极的电极反应式是
Al-3e-+4OH-=AlO2-+2H2O
Al-3e-+4OH-=AlO2-+2H2O
.用乙烯、甲苯、E三种原料合成高分子药物M和有机中间体L的路线如下:
已知:
Ⅰ.
Ⅱ.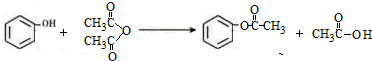
Ⅲ.L是六元环酯,M分子式是(C15H16O6)n
回答下列问题:
(1)B中官能团的名称是 ,D的结构简式是 .
(2)E→F的反应条件是 ,H→J的反应类型是 .
(3)F→G的化学反应方程式是 .
(4)K→M属于加聚反应,M的结构简式是 .
(5)碱性条件下,K水解的化学反应方程式是 .
(6)符合下列条件的C的同分异构体的结构简式是 .
①属于芳香族化合物;
②能发生银镜反应;
③核磁共振氢谱有4组峰,且峰面积之比为1:1:2:2.
查看习题详情和答案>>

已知:
Ⅰ.

Ⅱ.

Ⅲ.L是六元环酯,M分子式是(C15H16O6)n
回答下列问题:
(1)B中官能团的名称是
(2)E→F的反应条件是
(3)F→G的化学反应方程式是
(4)K→M属于加聚反应,M的结构简式是
(5)碱性条件下,K水解的化学反应方程式是
(6)符合下列条件的C的同分异构体的结构简式是
①属于芳香族化合物;
②能发生银镜反应;
③核磁共振氢谱有4组峰,且峰面积之比为1:1:2:2.
有机物X是有机合成工业中一种重要的中间体.X可以由有机物A经过一系列反应制得,也可由另一种有机物Y在一定条件下制得.合成路径如图所示:
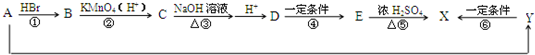
②Y是一种能使Br2的CCl4溶液褪色的二元羧酸,分子中C、H、O的个数比为1:1:1
③E和X中都含有五元环.
请回答以下问题:
(1)反应类型:反应② ,反应⑤ .
(2)A的结构简式为 ,E的分子式为 .
(3)反应①和②的顺序 (填“能”或“否”)交换,理由是: .
(4)化合物D在浓H2SO4催化作用下能生成一种高分子化合物,该反应的化学方程式为: .
(5)化合物D有多种同分异构体,其中满足以下条件的有 种,请写出其中一种的结构简式 .
①一定条件下能发生水解反应生成甲酸
②一定量该物质与足量钠或碳酸氢钠反应生成气体的物质的量相等.
查看习题详情和答案>>
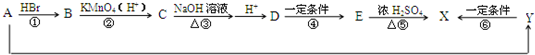
②Y是一种能使Br2的CCl4溶液褪色的二元羧酸,分子中C、H、O的个数比为1:1:1
③E和X中都含有五元环.
请回答以下问题:
(1)反应类型:反应②
(2)A的结构简式为
(3)反应①和②的顺序
(4)化合物D在浓H2SO4催化作用下能生成一种高分子化合物,该反应的化学方程式为:
(5)化合物D有多种同分异构体,其中满足以下条件的有
①一定条件下能发生水解反应生成甲酸
②一定量该物质与足量钠或碳酸氢钠反应生成气体的物质的量相等.