摘要:32.在标准状况下.将100mLH2S和O2混合气体点燃反应后恢复到原状况.发现随 混和气体中O2所占的体积V氧气的变化.反应后所得气体的总体积V总也不同.其关系式如下图所示(气体体积均在同温同压下测定).请回答下列问题: (1)写出图中B.C两点处的化学反应方程式: B点的反应: , C点的反应: . (2)通过对图像的分析得出: ①当V总>40mL.②V总<40mL.③V总=40mL时气体的成分: AB段 BD段 ①V总>40mL ②V总<40mL ③V总=40mL (3) 当V总=25mL时.求原混合气体中H2S和O2的体积各多少mL?
网址:http://m.1010jiajiao.com/timu3_id_356331[举报]
(2011?怀化一模)化学一化学与技术
我国有丰富的天然气资源.以天然气为原料合成尿素的主要流程如图所示(图中某些转化步骤及生成物未列出)
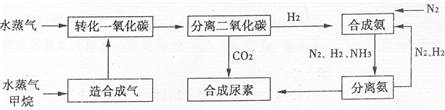
请填写下列空白:
(1)合成尿素的反应分二步,请写出该反应的化学方程式
①
②
(2)依据流程圈,判断下列说法正确的是
A.在转化CO的过程中使用催化剂,可以提高CO的转化率
B.进入分离二氧化碳装置的气体有2种
C.N2、H2的循环使用,提高了原子的利用率
D.二氧化碳与氨合成尿素属于人工固氮
E.流程中的原料有3种取之不尽,用之不完
(3)合成氨选择的外界条件是:催化剂,20~50MPa的压强,500℃的温度.选择该温度的主要原因是
(4)已知制造合成气的反应为CH4(g)+H2O(g)?CO(g)+3H2(g),该反应的平衡常数表达式为K=
.降低温度K减小,则正反应是一个
查看习题详情和答案>>
我国有丰富的天然气资源.以天然气为原料合成尿素的主要流程如图所示(图中某些转化步骤及生成物未列出)

请填写下列空白:
(1)合成尿素的反应分二步,请写出该反应的化学方程式
①
2NH3+CO2
NH2COONH4
| ||
2NH3+CO2
NH2COONH4
;
| ||
②
NH2COONH4
CO(NH2)2+H2O
| ||
NH2COONH4
CO(NH2)2+H2O
.
| ||
(2)依据流程圈,判断下列说法正确的是
C
C
.A.在转化CO的过程中使用催化剂,可以提高CO的转化率
B.进入分离二氧化碳装置的气体有2种
C.N2、H2的循环使用,提高了原子的利用率
D.二氧化碳与氨合成尿素属于人工固氮
E.流程中的原料有3种取之不尽,用之不完
(3)合成氨选择的外界条件是:催化剂,20~50MPa的压强,500℃的温度.选择该温度的主要原因是
500℃的温度反应速率较快,催化剂活性最高
500℃的温度反应速率较快,催化剂活性最高
.(4)已知制造合成气的反应为CH4(g)+H2O(g)?CO(g)+3H2(g),该反应的平衡常数表达式为K=
| c(CO)?c3(H2) |
| c(CH4)?c(H2O) |
| c(CO)?c3(H2) |
| c(CH4)?c(H2O) |
吸
吸
热反应.当造合成气的反应中甲烷的转化率为75%.合成氨中氢气的转化率为40%(其他过程的损失不计)以5.60xlO7L甲烷为原料能够合成4.48xlO7L
4.48xlO7L
L氨气.(假设体积均在标准状况下测定)I.下列实验操作、试剂保存方法和实验室事故处理,一定正确的是
A.实验室中,浓硝酸保存在带橡胶塞的棕色细口试剂并中;
B.制备氢氧化铁胶体时,应向20mL沸水中逐滴滴加1~2mL饱和的FeCl3溶液,并继续加热到液体呈透明的红褐色为止;
C.在石油的分馏实验中,温度计需插入液体中;
D.不慎将浓碱液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液;
E.用酸式滴定管量取20.00mL高锰酸钾酸性溶液;
F.在进行中和热测定时,为保证实验的准确性,我们可以采取以下具体措施:使用碎泡沫以起到隔热保温的作用、使用铜质搅拌棒进行搅拌、取用的碱溶液略过量、进行两到三次实验取平均值.
II.汽车尾气的主要成分为CO2及CO、NOX(NO和NO2)的混合物,其中NO的体积分数占95%以上)等.治理方法之一是在汽车排气管上加装“催化转换器”,利用催化剂使CO和NOX发生反应大部分转化为CO2和N2.某小组在实验室利用下图所示装置模拟处理汽车尾气中CO和NOX的反应并测量反应后混合气体的组成.(已知HCOOH
CO↑+H2O)
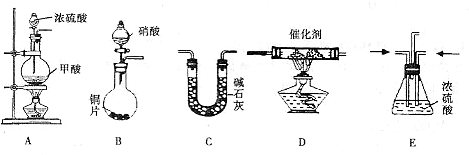
试回答下列问题:
(1)仪器的连接顺序为 ( )→( )→( )→收集气体
( )→( )→( )→收集气体
(2)E装置的作用是
(3)写出D中的NOX与CO反应的化学方程式
(4)若B容器中生成的NOX为NO,写出该反应的化学方程式,并标出电子转移的方向和数目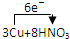 =3Cu(NO3)2+2NO↑+4H2O
=3Cu(NO3)2+2NO↑+4H2O =3Cu(NO3)2+2NO↑+4H2O.
=3Cu(NO3)2+2NO↑+4H2O.
(5)若通入的NOX为NO,C装置增重8.8g,收集到的气体在标准状况下为4.48L(其相对分子质量为28.4).则收集到的气体中NO的物质的量为
(6)选择高效催化剂,将汽车尾气转化为无毒气体,便彻底解决了汽车尾气对环境的影响,这种说法是否正确并阐述理由:
查看习题详情和答案>>
BDE
BDE
(填序号).A.实验室中,浓硝酸保存在带橡胶塞的棕色细口试剂并中;
B.制备氢氧化铁胶体时,应向20mL沸水中逐滴滴加1~2mL饱和的FeCl3溶液,并继续加热到液体呈透明的红褐色为止;
C.在石油的分馏实验中,温度计需插入液体中;
D.不慎将浓碱液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液;
E.用酸式滴定管量取20.00mL高锰酸钾酸性溶液;
F.在进行中和热测定时,为保证实验的准确性,我们可以采取以下具体措施:使用碎泡沫以起到隔热保温的作用、使用铜质搅拌棒进行搅拌、取用的碱溶液略过量、进行两到三次实验取平均值.
II.汽车尾气的主要成分为CO2及CO、NOX(NO和NO2)的混合物,其中NO的体积分数占95%以上)等.治理方法之一是在汽车排气管上加装“催化转换器”,利用催化剂使CO和NOX发生反应大部分转化为CO2和N2.某小组在实验室利用下图所示装置模拟处理汽车尾气中CO和NOX的反应并测量反应后混合气体的组成.(已知HCOOH
| ||
| △ |

试回答下列问题:
(1)仪器的连接顺序为
 ( )→( )→( )→收集气体
( )→( )→( )→收集气体(2)E装置的作用是
干燥混合气体
干燥混合气体
、通过观察气泡,调节气体流速,使气体充分混合
通过观察气泡,调节气体流速,使气体充分混合
.(3)写出D中的NOX与CO反应的化学方程式
2NOx+2xC
N2+2xCO2;
| 催化剂 |
| 加热 |
2NOx+2xC
N2+2xCO2;
.| 催化剂 |
| 加热 |
(4)若B容器中生成的NOX为NO,写出该反应的化学方程式,并标出电子转移的方向和数目
 =3Cu(NO3)2+2NO↑+4H2O
=3Cu(NO3)2+2NO↑+4H2O =3Cu(NO3)2+2NO↑+4H2O
=3Cu(NO3)2+2NO↑+4H2O(5)若通入的NOX为NO,C装置增重8.8g,收集到的气体在标准状况下为4.48L(其相对分子质量为28.4).则收集到的气体中NO的物质的量为
0.04mol
0.04mol
.(6)选择高效催化剂,将汽车尾气转化为无毒气体,便彻底解决了汽车尾气对环境的影响,这种说法是否正确并阐述理由:
不正确,因为①该反应为可逆反应,不能反应完全,②没达到“零碳排放”的目的,对气候的变化存在潜在的影响和危害
不正确,因为①该反应为可逆反应,不能反应完全,②没达到“零碳排放”的目的,对气候的变化存在潜在的影响和危害
.(12分) 某一反应体系中,有反应物和生成物共六种物质,这六种物质是:Cl2、KMnO4、MnCl2、H2O、HCl(浓)、KCl,其中KMnO4 → MnCl2 。
(1)该反应中的化学方程式为_____________________________________________。
(2)该反应中,氧化产物与还原产物的物质的量之比为_____________________________。
(3)若产生的气体在标准状况下体积为2.24 L,则反应过程中被氧化的物质为________ NA(NA表示阿伏伽德罗常数的值)。
(4)市售的浓盐酸(密度为1.19g/cm3)在工业上是用500 L HCl气体(标准状况)与1 L H2O的比例配制成的,则该盐酸的物质的量浓度是___________mol/L(结果保留一位小数)。
(5)现需用1.20 mol/L的稀盐酸480 mL, 应量取市售浓盐酸________mL进行配制。
(5)取6.00 g硬铝合金(假设只含铝铜硅),与 (5) 中所配稀盐酸进行充分反应,收集到气体5.60 L(标准状况),则硬铝合金中铝的质量分数为____________。
查看习题详情和答案>>