摘要:烧瓶中盛有氨气.经测定其密度为同温同压下氢气密度的9.5倍.以此进行“喷泉 实验.进入烧瓶中液体的体积最多可占烧瓶容积的 A.7/8 B.5/6 C.6/7 D.3/4
网址:http://m.1010jiajiao.com/timu3_id_356279[举报]
(2012?四川)甲、乙两个研究性学习小组为测定氨分子张氮、氢原子个数比,设计了如下实验流程:

试验中,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜.反应完成后,黑色的氧化铜转化为红色的铜.
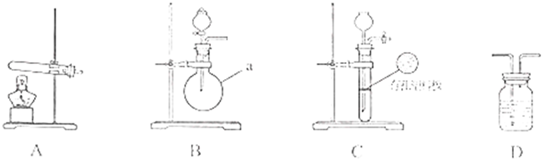
下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛,有浓硫酸的洗气瓶.
甲小组测得:反应前氧化铜的质量为m1 g、氧化铜反应后剩余固体的质量为m2 g生成氮气在标准状况下的体积V1L.
乙小组测得:洗气前装置D的质量m3 g、洗气后装置后D的质量m4 g、生成氮气在标准状况下的体积V2L.
请回答下列问题:
(1)写出仪器a的名称:
(2)检查A装置气密性的操作时
(3)甲、乙两小组选择了不同方法制取氨气,请将实验装置的字母编号和制备原理填写在下表空格中.
(4)甲小组用所测数据计算出氨分子中氮、氢的原子个数之比为
(5)乙小组用所测数据计算出氨分子中氮、氢的原子个数比名校小于理论值,其原因是
查看习题详情和答案>>

试验中,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜.反应完成后,黑色的氧化铜转化为红色的铜.
下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛,有浓硫酸的洗气瓶.

甲小组测得:反应前氧化铜的质量为m1 g、氧化铜反应后剩余固体的质量为m2 g生成氮气在标准状况下的体积V1L.
乙小组测得:洗气前装置D的质量m3 g、洗气后装置后D的质量m4 g、生成氮气在标准状况下的体积V2L.
请回答下列问题:
(1)写出仪器a的名称:
圆底烧瓶
圆底烧瓶
.(2)检查A装置气密性的操作时
连接导管,将导管插入水中;加热试管,导管口有气泡产生;停止加热,导管内有水回流并形成一段稳定的水柱.
连接导管,将导管插入水中;加热试管,导管口有气泡产生;停止加热,导管内有水回流并形成一段稳定的水柱.
.(3)甲、乙两小组选择了不同方法制取氨气,请将实验装置的字母编号和制备原理填写在下表空格中.
| 实验装置 | 实验药品 | 制备原理 | |||||||||
| 甲小组 | A | 氢氧化钙、硫酸铵 | 反应的化学方程式为 ① (NH4)2SO4+Ca(OH)2
(NH4)2SO4+Ca(OH)2
| ||||||||
| 乙小组 | ② B B |
浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用: ③ 氢氧化钠溶于氨水后放热、增加氢氧根浓度,使NH3+H2O?NH3?H2O?NH4++OH-向逆方向移动,加快氨气逸出 氢氧化钠溶于氨水后放热、增加氢氧根浓度,使NH3+H2O?NH3?H2O?NH4++OH-向逆方向移动,加快氨气逸出 |
5V1:7(m1-m2)
5V1:7(m1-m2)
.(5)乙小组用所测数据计算出氨分子中氮、氢的原子个数比名校小于理论值,其原因是
洗气瓶D中的浓硫酸不但吸收了反应生成的水,还吸收了未反应的氨气,从而使计算的氢的量偏高
洗气瓶D中的浓硫酸不但吸收了反应生成的水,还吸收了未反应的氨气,从而使计算的氢的量偏高
.为此,乙小组在原有实验的基础上增加了一个装有药品的实验仪器,重新实验.根据实验前后该药品的质量变化及生成氮气的体积,得出合理的实验结果.该药品的名称是碱石灰(氢氧化钠、氧化钙等)
碱石灰(氢氧化钠、氧化钙等)
.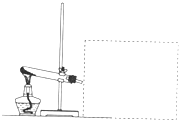 看图回答下列问题(部分仪器已被虚线遮挡,且虚线部分仪器可以根据需要添加)
看图回答下列问题(部分仪器已被虚线遮挡,且虚线部分仪器可以根据需要添加)(1)如果在虚线部分增加收集装置,上图中装置可用于实验室制取氨气,请回答以下问题:
①可以用
瓶口向下排空气法
瓶口向下排空气法
方法收集氨气,如果用烧瓶收集氨气,请用文字叙述如何检验氨气己收集满用湿润的红色石蕊试纸靠近瓶口,试纸变蓝,说明已收集满
用湿润的红色石蕊试纸靠近瓶口,试纸变蓝,说明已收集满
;②利用①中收集的氨气可以完成喷泉实验,是因为氨气具有
极易溶于水
极易溶于水
的物理性质;③写出实验室制氨气的化学反应方程式
2NH4Cl+Ca(OH)2═CaCl2+2NH3↑+2H2O
2NH4Cl+Ca(OH)2═CaCl2+2NH3↑+2H2O
;(2)上图装置还可以用于完成某些固体物质受热分解的实验.请回答:
①Na2CO3和NaHCO3这两种物质中有一种可以用上图装置进行受热分解的实验.该物质受热分解的化学反应方程式为:
2NaHCO3
Na2CO3+H2O+CO2↑
| ||
2NaHCO3
Na2CO3+H2O+CO2↑
;
| ||
②为了验证①中该物质受热分解产生的所有气体产物,在虚线处应连接(表述时请指明使用仪器,仪器中盛装的试剂和仪器的连接顺序)
先连接装有白色无水硫酸铜固体的干燥管,再连接装有澄清石灰水的烧杯
先连接装有白色无水硫酸铜固体的干燥管,再连接装有澄清石灰水的烧杯
;③请提出一点有关实验过程中安全问题的建议:
反应后先撤导气管,再撤酒精灯
反应后先撤导气管,再撤酒精灯
;④如果将12.6g的该物质加热分解,加热一段时间后,测得剩余固体质量为9.5g,则已经分解的该物质的质量为
8.4
8.4
g.在制氯气时有如下操作,操作顺序正确的是
[ ]
①连接好装置,检查气密性②缓缓加热,加快反应,使气体均匀逸出③在圆底烧瓶中加入二氧化锰粉末 ④从盛有浓盐酸的分液漏斗中将浓盐酸缓缓滴入烧瓶中⑤将多余的Cl2用NaOH溶液吸收⑥用向上排空气法收集氯气
A.①②③④⑤⑥
B.③④②①⑥⑤
C.①④③②⑥⑤
D.①③④②⑥⑤
查看习题详情和答案>>
A.①②③④⑤⑥
B.③④②①⑥⑤
C.①④③②⑥⑤
D.①③④②⑥⑤