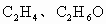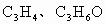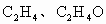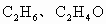网址:http://m.1010jiajiao.com/timu3_id_355995[举报]
(1)常温下,X、Y的水溶液的pH均为5.则两种水溶液中由水电离出的H+浓度之比是
(2)A、B、D、E四种元素组成的某无机化合物,受热易分解.写出少量该化合物溶液与足量的Ba(OH)2溶液反应的离子方程式
(3)A、B、D、E四种元素组成的某无机化合物浓度为0.1mol/L时,pH最接近
A.5.6B.7.0 C.8.4D.13.0
(4)在一个装有可移动活塞的容器中进行如下反应:C2(g)+3A2(g)
 2CA3(g)
2CA3(g)△H=-92.4kJ?mol-1.反应达到平衡后,测得容器中含有C2 0.5mol,A2 0.2mol,CA3 0.2mol,总容积为1.0L.
①如果达成此平衡前各物质起始的量有以下几种可能,其中不合理的是
A.C2 0.6mol,A2 0.5mol,CA3 0mol
B.C2 0mol,A2 0mol,CA3 1.2mol
C.C2 0.6mol/L,A2 0.5mol/L,CA3 0.2mol/L
②求算此平衡体系的平衡常数K=
③如果保持温度和压强不变,向上述平衡体系中加入0.18molC2,平衡将
| 1.00 |
| 0.9 |
| c2(NH3) |
| c(N2)×c3(H2) |
(
| ||||
(
|
| 1.00 |
| 0.9 |
| c2(NH3) |
| c(N2)×c3(H2) |
(
| ||||
(
|
④已知0.4mol 液态C2 A4与足量的液态双氧水反应,生成C2和水蒸气,放出256.65kJ的热量.写出该反应的热化学方程式
(15分) A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图。请针对以下三种不同情况回答:
(1)若A、B、C中均含同一种常见金属元素,该元素在 C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。
① A中含有的金属元素的原子结构示意图为 。
② 该金属元素的单质与某红色氧化物在高温下反应,可用于焊接铁轨及定向爆破,已知:1mol该单质完全反应,当温度恢复至298K时,共放热QkJ,请写出该反应的热化学反应方程式为 。
(2)若A为有机物,75%的A溶液可作为消毒剂,常温常压下B、C均为无色气体,C是一种常见的灭火剂。则A的结构简式为: ;利用原电池原理,将B、X分别通入由A制成的两多孔电极,以20%—30%的KOH溶液作为电解质溶液,可以组成化学电源,该电池放电时,负极电极反应式为 。
(3)若A、B、C的焰色反应均呈黄色,水溶液均为碱性。
①用化学方程式表明C溶液呈碱性的原因 。
②将4.48 L(标准状况下)X通入100 mL3 mol/L A的水溶液后,溶液中离子浓度由大到小的顺序为 。
③自然界中存在B、C和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100 mL溶液,测得溶液中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为___________________。
查看习题详情和答案>>
A、B、C、D、E为五种常见的短周期元素,常温下,A、B可形成B2A2和B2A两种液态化合物,B与D可组成分子X,X水溶液呈碱性,C元素的焰色反应呈黄色,E与C同周期,且E的简单离子半径是同周期元素形成的简单离子中半径最小的。试回答:
(1)D元素在周期表中的位置为 。
(2)B2 A和X的分子结合质子 的能力不同,只用一个离子方程式就能证明,写出该离子反应方程式 。
(3)A、D、E三种元素形成的盐(化学式A9D3E)的水溶液呈酸性,用离子方程式解释其原因 ;
(4)W、Q是由A、B、C、D四种元素中任意三种组成的不同类型的强电解质,常温下0.1mol·L—1W的水溶液的pH为13,Q的水溶液呈酸性且能和W反应放出气体,物质的量浓度相同的 W、Q溶液中水的电离程度是前者小于后者。则:W为 ,Q为 (填化学式)。
(5)B和E形成的化合物E2B6常在有机合成中作强还原剂,甚至可将二氧化碳重新还原成甲烷,写出该反应方程式 。
(6)已知工业合成X的反应方程式:D2
(g)+3B2 (g) 2X(g);△H
=-92.4 kJ·mol-1 ,在适当的催化剂和恒温恒压条件下反应,下列说法正确的有 。
2X(g);△H
=-92.4 kJ·mol-1 ,在适当的催化剂和恒温恒压条件下反应,下列说法正确的有 。
A.达到化学平衡时,正逆反应速率相等
B.反应过程中不断分离出X,使平衡常数K减小,平衡正向移动有利于合成X
C.达到平衡后,升高温度,平衡常数K增大,B2的转化率降低
D.达到化学平衡的过程中,气体平均相对分子质量减小
查看习题详情和答案>>