题目内容
A、B、C、D、E为五种常见的短周期元素,常温下,A、B可形成B2A2和B2A两种液态化合物,B与D可组成分子X,X水溶液呈碱性,C元素的焰色反应呈黄色,E与C同周期,且E的简单离子半径是同周期元素形成的简单离子中半径最小的。试回答:
(1)D元素在周期表中的位置为 。
(2)B2 A和X的分子结合质子 的能力不同,只用一个离子方程式就能证明,写出该离子反应方程式 。
(3)A、D、E三种元素形成的盐(化学式A9D3E)的水溶液呈酸性,用离子方程式解释其原因 ;
(4)W、Q是由A、B、C、D四种元素中任意三种组成的不同类型的强电解质,常温下0.1mol·L—1W的水溶液的pH为13,Q的水溶液呈酸性且能和W反应放出气体,物质的量浓度相同的 W、Q溶液中水的电离程度是前者小于后者。则:W为 ,Q为 (填化学式)。
(5)B和E形成的化合物E2B6常在有机合成中作强还原剂,甚至可将二氧化碳重新还原成甲烷,写出该反应方程式 。
(6)已知工业合成X的反应方程式:D2
(g)+3B2 (g)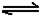 2X(g);△H
=-92.4 kJ·mol-1 ,在适当的催化剂和恒温恒压条件下反应,下列说法正确的有 。
2X(g);△H
=-92.4 kJ·mol-1 ,在适当的催化剂和恒温恒压条件下反应,下列说法正确的有 。
A.达到化学平衡时,正逆反应速率相等
B.反应过程中不断分离出X,使平衡常数K减小,平衡正向移动有利于合成X
C.达到平衡后,升高温度,平衡常数K增大,B2的转化率降低
D.达到化学平衡的过程中,气体平均相对分子质量减小
(1)第二周期ⅤA族
(2)H3O++NH3=NH4++H2O
(3)Al3++3H2O Al(OH)3+3H+
Al(OH)3+3H+
(4)W NaOH ,Q NH4NO3
(5)3CO2+2Al2H6=3CH4+2Al2O3
(6)A
【解析】
试题分析:根据题意得出A、B、C、D、E元素分别为O、H、Na、N、Al。(2)结合质子(H+) 的能力不同,可以通过一种物质把另一种物质中结合的质子夺走来加以证明;(3)A、D、E三种元素形成的盐为Al(NO3)3,铝离子水解溶液呈酸性;(4)常温下0.1mol·L—1W的水溶液的pH为13,即氢氧根离子浓度为0.1mol·L—1,确定为一元强碱溶液,故为A为NaOH;Q的水溶液呈酸性且能和W反应放出气体,确定为NH4NO3;(6)A、平衡状态的标志,正逆反应速率相等,正确;B、温度不变,平衡常数不变,错误;C、反应为放热反应,升高温度平衡逆向移动,平衡常数变小,反应物转化率降低,错误;D、在达到平衡的过程中,随反应进行气体的物质的量变少,但总质量不变,摩尔质量变大,错误。
考点:考查物质结构与平衡的有关问题。

 学业测评一课一测系列答案
学业测评一课一测系列答案现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
(2)B基态原子中能量最高的电子,其电子云在空间有
形.
(3)画出C原子的电子排布图
(4)已知BA5为离子化合物,写出其电子式
(5)DE3中心原子的杂化方式为
(6)用电子式表示F元素与E元素形成化合物的形成过程
 A、B、C、D、E为中学化学常见物质,其中A、C为金属单质,E为非金属单质,下图是它们之间的相互转化关系.请回答:
A、B、C、D、E为中学化学常见物质,其中A、C为金属单质,E为非金属单质,下图是它们之间的相互转化关系.请回答:

