网址:http://m.1010jiajiao.com/timu3_id_355105[举报]
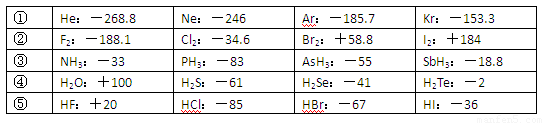
| ① | He:-268.8 | Ne:-246 | Ar:-185.7 | Kr:-153.3 |
| ② | F2:-188.1 | Cl2:-34.6 | Br2:+58.8 | I2:+184 |
| ③ | NH3:-33 | PH3:-83 | AsH3:-55 | SbH3:-18.8 |
| ④ | H2O:+100 | H2S:-61 | H2Se:-41 | H2Te:-2 |
| ⑤ | HF:+20 | HCl:-85 | HBr:-67 | HI:-36 |
(1)判断下列说法不正确的是
A.同周期元素的氢化物,原子序数越大,沸点越高
B.上表中H2O、HF中由于含有氢键,故其分子特别稳定
C.上表中,多数物质的沸点均与相对分子质量存在一定的关系
D.周期表中各主族元素的单质其沸点都随原子序数的增大而升高
E.氢化物的稳定性越高,其沸点越高
(2)写出②系列中物质主要化学性质的递变规律(任写一种):
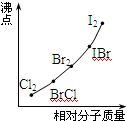
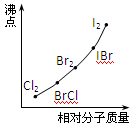
(3)部分XX′型卤素互化物(X、X′表示不同的卤原子)和卤素单质的沸点也与其相对分子质量存在着如图所示的关系.试推测ICl的沸点所处的最小范围
(10分)已知一些单质、化合物的沸点(1.01×105Pa,单位:℃)如下表所示:
结合上表有关信息回答下列问题:
(1)判断下列说法不正确的是
A.同周期元素的氢化物,原子序数越大,沸点越高
B.上表中H2O、HF中由于含有氢键,故其分子特别稳定
C.上表中,多数物质的沸点均与相对分子质量存在一定的关系
D.周期表中各主族元素的单质其沸点都随原子序数的增大而升高
E.氢化物的稳定性越高,其沸点越高
(2)写出②系列中物质主要化学性质的递变规律(任写一种): ;能说明该递变规律的化学事实是 (任写一例,用离子方程式表示)。
(3)除极少数情况,同一系列中物质的沸点与相对分子质量之间存在一定的关系,该关系是 。
(4)部分XX’型卤素互化物(X、X’表示不同的卤原子)和卤素单质的沸点也与其相对分子质量存在着如右图所示的关系。试推测ICl的沸点所处的最小范围 (填“物质的化学式”)。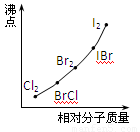
查看习题详情和答案>>
(10分)已知一些单质、化合物的沸点(1.01×105Pa,单位:℃)如下表所示: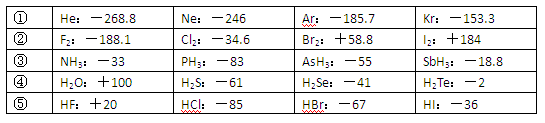
结合上表有关信息回答下列问题:
(1)判断下列说法不正确的是
| A.同周期元素的氢化物,原子序数越大,沸点越高 |
| B.上表中H2O、HF中由于含有氢键,故其分子特别稳定 |
| C.上表中,多数物质的沸点均与相对分子质量存在一定的关系 |
| D.周期表中各主族元素的单质其沸点都随原子序数的增大而升高 |
(2)写出②系列中物质主要化学性质的递变规律(任写一种): ;能说明该递变规律的化学事实是 (任写一例,用离子方程式表示)。
(3)除极少数情况,同一系列中物质的沸点与相对分子质量之间存在一定的关系,该关系是 。
(4)部分XX’型卤素互化物(X、X’表示不同的卤原子)和卤素单质的沸点也与其相对分子质量存在着如右图所示的关系。试推测ICl的沸点所处的最小范围 (填“物质的化学式”)。
 查看习题详情和答案>>
查看习题详情和答案>>
例:在密闭容器中的一定量混合气体发生反应:a A(g)+b B(g) ![]() c C(g),达到平衡后,测得A的浓度为0.7mol·L-1,在温度不变的情况下,将容器的容积扩大到原来的两倍,测得A的浓度为0.4mol·L-1,则下列判断正确的是( )
c C(g),达到平衡后,测得A的浓度为0.7mol·L-1,在温度不变的情况下,将容器的容积扩大到原来的两倍,测得A的浓度为0.4mol·L-1,则下列判断正确的是( )
A. a+b<c B. C的体积分数下降
C. B的浓度增大 D. A的转化率增大
查看习题详情和答案>>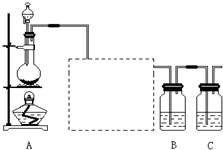 已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:(1)装置A的分液漏斗中盛装的试剂是
(2)画出虚线框内的实验装置图,并注明所加试剂,


(3)装置B中盛放的试剂是
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)从原子结构的角度简要分析氯元素的非金属性比硫元素的非金属性强的原因.
(5)还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强(试举一例).
(6)装置C中盛放烧碱溶液,目的是吸收反应后剩余的气体,防止污染空气.在该反应中,Cl元素的化合价既有升高又有降低,即在反应中Cl元素的原子既能获得电子也能失去电子,能否说氯元素既具有金属性又具有非金属性?简述你的理由.