题目内容
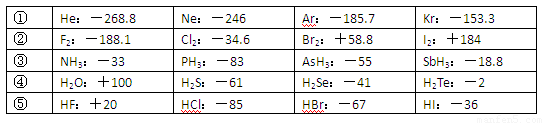
(10分)已知一些单质、化合物的沸点(1.01×105Pa,单位:℃)如下表所示: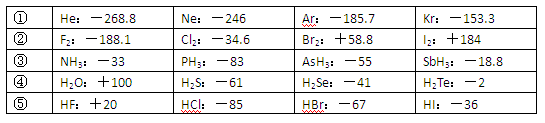
结合上表有关信息回答下列问题:
(1)判断下列说法不正确的是
| A.同周期元素的氢化物,原子序数越大,沸点越高 |
| B.上表中H2O、HF中由于含有氢键,故其分子特别稳定 |
| C.上表中,多数物质的沸点均与相对分子质量存在一定的关系 |
| D.周期表中各主族元素的单质其沸点都随原子序数的增大而升高 |
(2)写出②系列中物质主要化学性质的递变规律(任写一种): ;能说明该递变规律的化学事实是 (任写一例,用离子方程式表示)。
(3)除极少数情况,同一系列中物质的沸点与相对分子质量之间存在一定的关系,该关系是 。
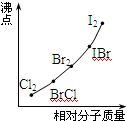
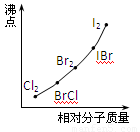
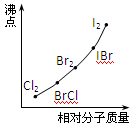
(4)部分XX’型卤素互化物(X、X’表示不同的卤原子)和卤素单质的沸点也与其相对分子质量存在着如右图所示的关系。试推测ICl的沸点所处的最小范围 (填“物质的化学式”)。
(10分)(每空2分)
(1)ABDE;(2)单质的氧化性逐渐减弱,Cl2+2Br-=2Cl-+Br2;
(3)随相对分子质量增大,沸点升高。(4)介于Br2的沸点和IBr沸点之间。
解析试题分析:(1)根据表中氢化物沸点的数据变化可知,信息ABDE均是正确的。C不正确,因为HF、H2O、NH3等分子间均存在氢键,从而导致沸点偏高。
(2)②系列中元素都是同主族元素,同主族自上而下,非金属性逐渐减弱,单质的氧化性逐渐减弱,因此根据非金属性较强的能置换出就发现减弱的课,反应的离子方程式可以是Cl2+2Br-=2Cl-+Br2。
(3)表中物质形成的晶体都是分子晶体,分子晶体的熔沸点与分子间作用力的强弱有关系,所以该关系应该是随相对分子质量增大,沸点升高。
(4)由于ICl的沸点高于IBr的发生,且ICl的相对分子质量高于单质溴的,所以根据图像可知,ICl的沸点所处的最小范围是介于Br2的沸点和IBr沸点之间。
考点:考查元素周期律的应用与判断、氢键的应用以及物质沸点高低的比较
点评:该题是中等难度的试题,试题基础性强,侧重能力的培养和解题方法的训练与指导。作用是考查学生对元素周期律的了解掌握程度以及灵活运用元素周期律解决实际问题的能力。有利于培养学生的灵活应变能力和知识的迁移能力。

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目