摘要:25. 375x + 1500 [(写成250×( )) 不扣分] 1∶3.3 (结果在52%-53%不扣分.其余不给分)
网址:http://m.1010jiajiao.com/timu3_id_35493[举报]
某研究性学习小组拟用铜屑与氧化铜混合物与硫酸和硝酸组成的混酸反应来制取CuSO4?5H2O晶体,混酸中硝酸的还原产物为NO,反应过程中不产生SO2,反应后的溶液中不含Cu(NO3)2,反应中固体完全溶解,两种酸均恰好完全反应.设固体混合物的总质量为480g,其中铜的质量分数为x,试回答下列.
(1)所得硫酸铜晶体的质量y为:
(2)若x=0.4,混酸中HNO3与H2SO4的物质的量之比为:
(3)若x=0.4,480g固体混合物与一定量混酸微热后,充分反应,冷却恰好只得到CuSO4?5H2O,试求原混酸中H2SO4的质量分数.
查看习题详情和答案>>
(1)所得硫酸铜晶体的质量y为:
375x+1500
375x+1500
(用x表示);(2)若x=0.4,混酸中HNO3与H2SO4的物质的量之比为:
1:3.3
1:3.3
;(3)若x=0.4,480g固体混合物与一定量混酸微热后,充分反应,冷却恰好只得到CuSO4?5H2O,试求原混酸中H2SO4的质量分数.
【物质结构与性质】
(1)金属镁有许多重要的用途,格利雅试剂的结构简式可表示为RMgX,它是金属镁和卤代烃反应的产物,简称格氏试剂,它在醚的稀溶液中以单体形式存在,并与二分子醚络合,在浓溶液中以二聚体存在,结构如下图:


上述2种结构中均存在配位键,把你认为是配位键的用“→”标出.
(2)在短周期主族元素中,氯及其相邻元素的电负性由大到小的顺序是
(3)A、B、C为同一短周期金属元素.依据下表数据分析,C元素在化合物中的主要化合价为
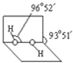 (4)已知过氧化氢分子的空间结构如图所示,分子中氧原子采取
(4)已知过氧化氢分子的空间结构如图所示,分子中氧原子采取
(5)R是1~36号元素中未成对电子数最多的原子.R3+在溶液中存在如下转化关系:
①基态R原子的价电子排布式为
②[R(OH)4]-中存在的化学键是
A.离子键 B.极性键 C.非极性键 D.配位键.
查看习题详情和答案>>
(1)金属镁有许多重要的用途,格利雅试剂的结构简式可表示为RMgX,它是金属镁和卤代烃反应的产物,简称格氏试剂,它在醚的稀溶液中以单体形式存在,并与二分子醚络合,在浓溶液中以二聚体存在,结构如下图:


上述2种结构中均存在配位键,把你认为是配位键的用“→”标出.
(2)在短周期主族元素中,氯及其相邻元素的电负性由大到小的顺序是
F>Cl>S
F>Cl>S
(用元素符号表示)(3)A、B、C为同一短周期金属元素.依据下表数据分析,C元素在化合物中的主要化合价为
+3
+3
;第二电离能(I2)B小于A的原因是A+外层电子排布为2s22p6稳定结构,难再失去一个电子.B+外层电子排布为3s1,易失去一个电子
A+外层电子排布为2s22p6稳定结构,难再失去一个电子.B+外层电子排布为3s1,易失去一个电子
.| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 500 | 4600 | 6900 | 9500 |
| B | 740 | 1500 | 7700 | 10500 |
| C | 580 | 1800 | 2700 | 11600 |
 (4)已知过氧化氢分子的空间结构如图所示,分子中氧原子采取
(4)已知过氧化氢分子的空间结构如图所示,分子中氧原子采取sp3
sp3
杂化;通常情况下,H2O2与水任意比互溶的主要原因是H2O2分子H2O分子之间形成氢键,使H2O2与水任意比互溶
H2O2分子H2O分子之间形成氢键,使H2O2与水任意比互溶
.(5)R是1~36号元素中未成对电子数最多的原子.R3+在溶液中存在如下转化关系:

①基态R原子的价电子排布式为
3d54s1
3d54s1
.②[R(OH)4]-中存在的化学键是
BD
BD
.A.离子键 B.极性键 C.非极性键 D.配位键.
(1)在短周期主族元素中,氯及其相邻元素的电负性由大到小的顺序是
(2)X是1~36号元素中未成对电子数最多的原子.
①基态X原子的价电子排布式为
②单质X相应晶体的组成微粒是
(3)A、B、R为同一短周期金属元素.依据下表数据分析,R元素在化合物中的主要化合价为
(4)已知:R(s)+
O2(g)=
R2O3(s)△H=-834.8kJ?mol-1
Mn(s)+O2(g)=MnO2(s)△H=-520.9kJ?mol-1
写出R的单质与MnO2反应的热化学方程式
查看习题详情和答案>>
F>Cl>S
F>Cl>S
(用元素符号表示)(2)X是1~36号元素中未成对电子数最多的原子.
①基态X原子的价电子排布式为
3d54s1
3d54s1
.②单质X相应晶体的组成微粒是
金属阳离子和自由电子
金属阳离子和自由电子
.(3)A、B、R为同一短周期金属元素.依据下表数据分析,R元素在化合物中的主要化合价为
+3
+3
;第二电离能(I2)B小于A的原因是A+外层电子排布为2s22p6稳定结构,难再失去一个电子.B+外层电子排布为3s1,易失去一个电子
A+外层电子排布为2s22p6稳定结构,难再失去一个电子.B+外层电子排布为3s1,易失去一个电子
.| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 500 | 4600 | 6900 | 9500 |
| B | 740 | 1500 | 7700 | 10500 |
| R | 580 | 1800 | 2700 | 11600 |
| 3 |
| 4 |
| 1 |
| 2 |
Mn(s)+O2(g)=MnO2(s)△H=-520.9kJ?mol-1
写出R的单质与MnO2反应的热化学方程式
Al(s)+
MnO2(s)=
Al2O3(s)+
Mn(s)△H=-444.1kJ?mol-1
| 3 |
| 4 |
| 1 |
| 2 |
| 3 |
| 4 |
Al(s)+
MnO2(s)=
Al2O3(s)+
Mn(s)△H=-444.1kJ?mol-1
.| 3 |
| 4 |
| 1 |
| 2 |
| 3 |
| 4 |
(2011?陕西一模)选修《物质结构》
三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池制造和液晶显示器制造中得到广泛应用.NF3是一种三角锥型分子,键角102°,沸点-129℃;可在铜的催化作用下由F2和过量NH3反应得到.
(1)写出制备 NF3的化学反应方程式:
(2)NF3的沸点比NH3的沸点(-33℃)低得多的主要原因是
(3)与铜属于同一周期,且未成对价电子数最多的元素基态原子核外电子排布式为
(4)理论上HF、NaAlO2和NaCl按6:1:2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,则该物质的化学式为
(5)根据下列五种元素的第一至第四电离能数据(单位:kJ?mol-1 ),回答下面各题:
①在周期表中,最可能处于同一族的是
②T元素最可能是
查看习题详情和答案>>
三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池制造和液晶显示器制造中得到广泛应用.NF3是一种三角锥型分子,键角102°,沸点-129℃;可在铜的催化作用下由F2和过量NH3反应得到.
(1)写出制备 NF3的化学反应方程式:
4NH3+3F2=NF3+3NH4F
4NH3+3F2=NF3+3NH4F
.(2)NF3的沸点比NH3的沸点(-33℃)低得多的主要原因是
NH3能形成氢键,NF3只有范德华力
NH3能形成氢键,NF3只有范德华力
.(3)与铜属于同一周期,且未成对价电子数最多的元素基态原子核外电子排布式为
1s22s22p63s23p63d54s1(或[Ar]3d54s1)
1s22s22p63s23p63d54s1(或[Ar]3d54s1)
.(4)理论上HF、NaAlO2和NaCl按6:1:2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,则该物质的化学式为
Na3AlF6
Na3AlF6
其中心离子是Al
Al
,配位数为6
6
.(5)根据下列五种元素的第一至第四电离能数据(单位:kJ?mol-1 ),回答下面各题:
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
R
R
和U
U
.②T元素最可能是
P
P
区元素.若T为第二周期元素,E是第三周期元素中原子半径最小的元素,则T、E形成化合物的空间构型为平面正三角形
平面正三角形
,其中心原子的杂化方式为sp2
sp2
.(2010?湘潭三模)N2O5是一种新型硝化剂,某温度下有反应:2N2O5(g)?4NO2(g)+O2(g),△H>0,下表为T1温度下的部分实验数据:
|
查看习题详情和答案>>